Titreren


|
Titreren |

|

|
|
Titreren (ook wel Volumetrie genoemd) is een analytische methode
waarmee we de meest uiteenlopende stoffen kwantitatief kunnen bepalen.
Sommige direct, zoals zuren en base; andere indirect, bv het
zuurstofgehalte in water.
Het principe van titreren is echter steeds hetzelfde: aan een hoeveelheid oplossing van onbekende concentratie wordt een hoeveelheid van bekende concentratie toegevoegd. De oplossing met een bekende concentratie noemt men de titervloeistof of titrator. De stoffen in de bekende en de onbekende oplossing moeten ook volledig met elkaar kunnen reageren. Uit de benodigde hoeveelheid van de bekende oplossing volgt, via de reactievergelijking, de sterkte van de onbekende oplossing. Al naar het soort van reactie kunnen we onderscheiden:
Bij elke titratie moet men weten wanneer de reactie afgelopen is. Bij zuur-base titraties worden hiervoor meestal kleurindicatoren gebruikt. Indicatoren zijn stoffen die in zeer kleine hoeveelheden aan het te titreren monster worden toegevoegd en bij het passeren van het equivalentiepunt (het exacte punt waarop de reactie afgelopen is) van kleur veranderen. Vrijwel alle zuren en basen kunnen op deze manier worden getitreerd. Het is echter wel belangrijk om altijd de juiste indicator te kiezen. Titreert me bv azijn met natronloog dan moet je als indicator fenolftaleÔne gebruiken. Neemt men methylrood of methyloranje, dan ontstaat een fout van enige procenten. |
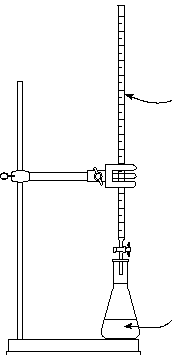 |
Buret gevuld met base |
Bij redoxtitraties wordt de stof in de
onbekende oplossing geoxideerd of gereduceerd door de stof in de bekende
oplossing.Uit de voor een volledige oxidatie (reductie) benodigde
hoeveelheid oxidator (reductor) volgt weer de sterkte van de onbekende
oplossing. Indicatoren zijn vaak niet nodig, omdat de vloeistof zelf bij
het passeren van het equivalentiepunt van kleur veranderd (bv bij
titraties met kaliumpermanganaat van kleurloos naar paars). Zeer veel
metaalionen hebben twee of meer valenties en kunnen door middel van een
redoxtitratie worden bepaald. Zuur-base- en redoxtitraties zijn zeer
geschikte methoden voor een laboratorium thuis. Veel of ingewikkeld
glaswerk is er niet voor nodig (pipet, buret, bekerglazen). De benodigde
chemicaliŽn (natronloog) zijn relatief goedkoop en makkelijk te verkrijgen.
Neerslag- en complexometrische titraties zijn moeilijker thuis uit te
voeren.
|
|||||||||||||||
|
Kolf gevuld met zuur en indicator. |
|||||||||||||||||
De titratie van zoutzuur met natronloog is een titratie waarvan we de titreercurve vrij makkelijk ook theoretisch kunnen afleiden. Titratie van zoutzuur met natronloog
Reaktievergelijkingen:
Dit is een titratie van een zeer sterk zuur met een zeer sterke base. Vergelijkingen:Als we HCl oplossen in water dan wordt het volledig gesplitst volgens bovenstaande reactievergelijking. De Cl- ionen reageren niet verder hetgeen betekent dat de chloride concentratie gelijk is aan de zoutzuur concentratie voor we beginnen met titreren. Dus: [Cl-] = c De elektroneutraliteitsvergelijking is het uitgangspunt van de berekeningen. Elke elektrolytoplossing is in haar geheel elektrisch neutraal. De som van alle positieve lading is dus gelijk aan de som van alle negatieve lading. Ionen dragen steeds een geheel aantal elementairladingen en we mogen dus zeggen dat de som van concentraties van de positieve ionen gelijk is aan de som van de concentraties van de negatieve ionen, mits men de concentraties van de meerwaardig geladen ionen met de vereiste factor vermenigvuldigt. De elektroneutraliteitsvergelijking wordt dan: [Cl-] + y = x + [Na+] (1) Onder
de omzettingsgraad l
verstaan we de
toegevoegde hoeveelheid reagens in mol gedeeld door de te bepalen
hoeveelheid stof in mol. Voor de titratie van een eenwaardig zuur met een
eenwaardige base ligt het equivalentiepunt dus bij l
=1.
|
|||||||||||||||||
|
Literatuur:
|
|||||||||||||||||
28-11-2004