Dendrietvormige keukenzout kristallen maken en onder de microscoop bekijken


|
Dendrietvormige keukenzout kristallen maken en onder de microscoop bekijken |

|

|
Datum: November 2015
Inleiding:
| Keukenzout bekijken onder de microscoop is het type experiment dat men in elk beginnersboek over microscopie kan vinden. De typische kubische structuur is kenmerkend voor natriumchloride kristallen Door minieme toevoegingen van een chemicaliën aan de moederloog oplossing kan men echter een heel andere structuur krijgen. |
Materiaal:
|
|
 |
|
|
|
|
Uitvoering en resultaat:
|
Resultaten:
| Keukenzoutkristallen |
 |
| Met roodbloedloogzout |
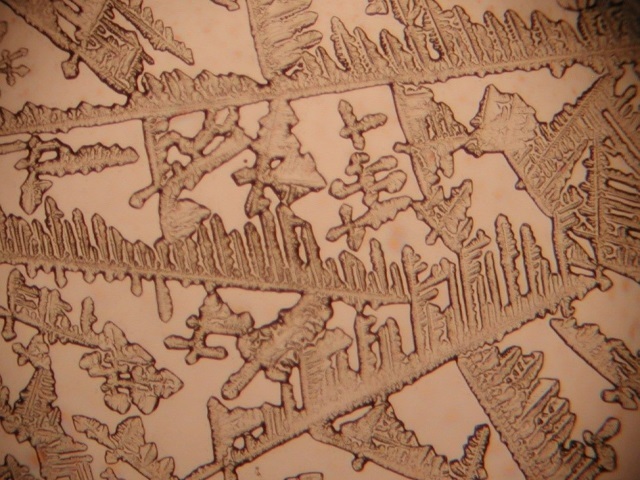 |
Discussie
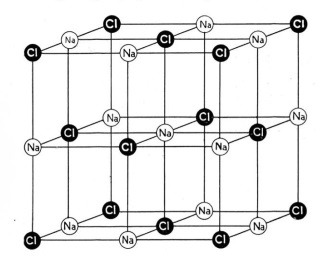
| Natriumchloride komt in de natuur voor als het kubische mineraal haliet. Kristallen van gegranuleerd zout zijn bijna altijd kleine kubusjes. Aangezien gegranuleerd zout gemakkelijk coaguleert (klompen vormt) vormt als de luchtvochtigheid hoog is voegt men kleine hoeveelheden van andere mineralen toe die coagulatie tegengaan. | |
 |
Het is eigenlijk helemaal niet zo gemakkelijk om zout te maken dat niet de typisch kubische structuur heeft. Keukenzout wordt gemaakt door natriumchloride op te lossen in water en vervolgens in te dampen. Afhankelijk van de condities tijdens indampen kunnen zich naast kubische kristallen ook schilfers en dendrieten vormen. Schilferachtige zoutkristallen worden gemaakt door voorzichtig oppervlakte verdamping van een brine (zoutoplossing) in vlakke pannen die open staan t.o.v. de atmosfeer. Nieuw gevormde kristallen blijven op het oplossingsoppervlak door de oppervlaktespanning van de oplossing. Ze groeien gedurende enige tijd lateraal (zijdelings) waarbij ze dan schilfers vormen die blijven drijven tot dusdanig gegroeid zijn dat ze naar de bodem zakken. |
| Dendriet vormig zout heeft vertakte of stervormige structuren die bereid worden door verdamping van brine die kleine hoeveelheden ferrocyanide ionen bevat (5 – 20 ppm). Belangrijke eigenschappen van dendritisch zout zijn een lage bulk dichtheid, snelle oplosbaarheid in water en een hoge water absorptie capaciteit zonder te coaguleren. Om deze redenen wordt dendritisch zout gebruikt in voedselproducten en als anticoagulatie middel in strooizout. Dendritische groei wordt door de sterke adsorptie van de ferrocyanide ion op de facetten van de groende zoutkristallen. De grootte en de lading van het ferrocyanide ion onderdrukken de nucleatie en de groei van het natriumchloride kristalvlak. Een opgelost zout kan oververzadigd raken bij de hoeken van een kristal met als gevolg dat preferentiële groei kan plaatsvinden op de hoeken en bij randen hetgeen resulteert in de vorming van pieken die karakteristiek zijn voor dendritische kristalgroei. Het proces is schematisch weergegeven in onderstaande figuur. | |
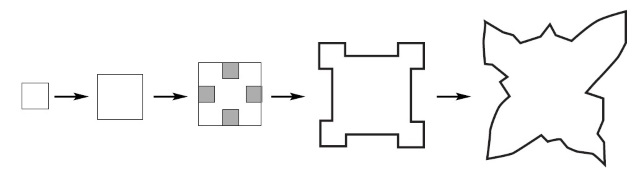 |
|
| Initiële kristalvorming produceert de normale kubische structuur. De vlakken van de kubus groeien uniform door de onregelmatigheden die op het kristaloppervlak aanwezig zijn. Bij een bepaalde kritische grootte beginnen ferrocyanide ionen de groei van de kristalvlakken te bellemmeren. Groei vindt dan preferentieel plaats op de randen en de hoeken van het kristal hetgeen dan uiteindelijk resulteert in de vorming van dendritische armen en een meer algemene sterachtige structuur van het kristal. | |
Opmerkingen
|
Literatuur:
|
24/02/2019