

| Een neutralisatiereactie gecombineerd met wat diffusie gevisualiseerd |
 |
 |
Datum: December 2015
Principe: Oplossingwarmte bepalen
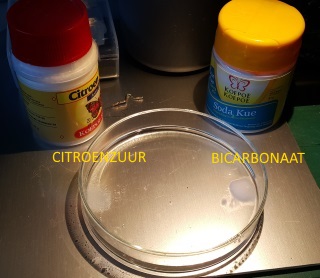
Materiaal:
|
 |
Uitvoering:
|
 |
Resultaten:
|
||||||||||||
Discussie en conclusie:
|
Een heel eenvoudig experimentje waarbij men enkele fysische en chemische principes demonstreert. Natriumbicarbonaat reageert met citroenzuur in water volgens de reacties:
Aangezien het CO2 uit het water ontwijkt is het geen evenwichtsreactie maar een reactie van het type A --> B. Het duurt enige tijd voordat we gasbelletjes kunne waarnemen. Daar zijn twee redenen voor:
Het grensvlak rood/geel, waar de neutralisatie reactie plaatsvindt is ook waarneembaar als er nog geen gasbellen waar te nemen. De kleuren geven een pH verschil aan, aan de linkerkant zuur, aan de rechterkant basisch. Het verschuiven van het front naar de rechterkant wordt veroorzaakt door de diffusie van de ionen. Diffusie is de verspreiding van moleculen door een gasvormig of een vloeibaar medium. De moleculen van gassen en vloeistoffen bewegen. Door deze bewegingen kunnen de moleculen tegen elkaar op botsen en verplaatsen ze zich door de hele ruimte van het medium. Uiteindelijk zijn alle moleculen door het hele medium verspreid waardoor overal een gelijke concentratie ontstaat. Men zegt dan ook wel dat het concentratieverschil de drijvende kracht is achter dit mechanisme. |
Opmerkingen:
|
Literatuur:
Relevante websites: |
Achtergrondinformatie:
|
Zuur - base theorie De moderne zuur base theorie is geformuleerd door BrÝnsted. Deze luidt samengevat als volgt: zuur <=> base + proton Deze reactievergelijking geeft een chemisch evenwicht weer: de reactie kan zowel naar links als naar rechts verlopen. De base en het zuur, die bij dit evenwicht zijn betrokken, noemt men geconjugeerd; dat wil zeggen ze zijn door protonenoverdracht gekoppeld. Uit een zuur ontstaat door afsplitsing van een proton de geconjugeerde base. Bv. HCO3- <=> CO32- + H+ Het water H2O kan zich zowel zuur als basisch gedragen, omdat het zowel protonen kan afsplitsen als opnemen: (1) H2O <=> H+
+ OH- Zuiver water is slechts voor een zeer
klein gedeelte gesplitst in ionen, zodat er maar kleine hoeveelheden
hydronium-ionen (H3O+) en hydroxylionen (OH-
) voorkomen. Protonen (H+) komen als vrije positieve
ionen niet voor, doch zijn in water steeds gebonden aan H2O-moleculen.
Het evenwicht (2) ligt zo sterk naar rechts dat praktisch alleen H3O+
voorkomt; het waterevenwicht moet dan ook feitelijk geschreven
worden als in vergelijking (3). |
||||
|
Diffusie Componenten die zich binnen een fase bewegen doen dit onder invloed van een concentratieverschil. Er ontstaat dus een stroom als gevolg van een oorzaak, de ďdrijvende krachtĒ. Voor een korte lengte Dx kunnen we dan een debietvergelijking opstellen:
HerdefiniŽren we deze in termen van eendimensionaal stationair transport dan krijgen we de wet van Fick waarin we de fluxvergelijking opstellen:
Volgens deze wet is de diffusiesnelheid rechtevenredig met het
concentratieverval. Hierin
is D de diffusiecoŽfficiŽnt in m2s-1. Het is
een temperatuurafhankelijke stofeigenschap en is een maat voor de
snelheid waarmee in het betreffende medium stof diffundeert.
in = uit + accumulatie
Hetgeen de tweede wet van Fick is die informatie geeft over de concentratieverandering in de tijd. |
24-12-2015