Synthese van calciumacetaat


|
Synthese van calciumacetaat |

|

|
Datum: Augustus - 2018
Inleiding:
| In het kader van mijn kristallisatie-experimenten besloot ik om calciumacetaat te maken. |
Materiaal:
|
|
 |
|
 |
|
Uitvoering:
| Synthese van Calciumacetaat | |
|
 |
|
 |
|
 |
| Microoscopie | |
|
|
| Ontleding van Cacliumacetaat | |
|
|
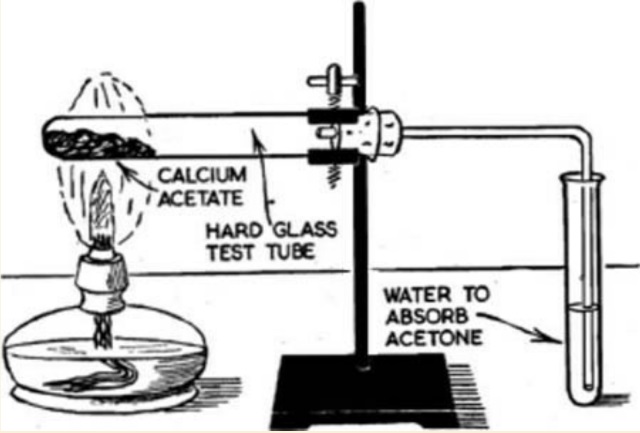 |
|
| Iodoform aantoningsreactie | |
|
|
| Residu analyse | |
|
|
Resultaten:
| Het calciumacetaat dat zich vormt is een wit poeder. | |
 |
|
| Microscopie | |
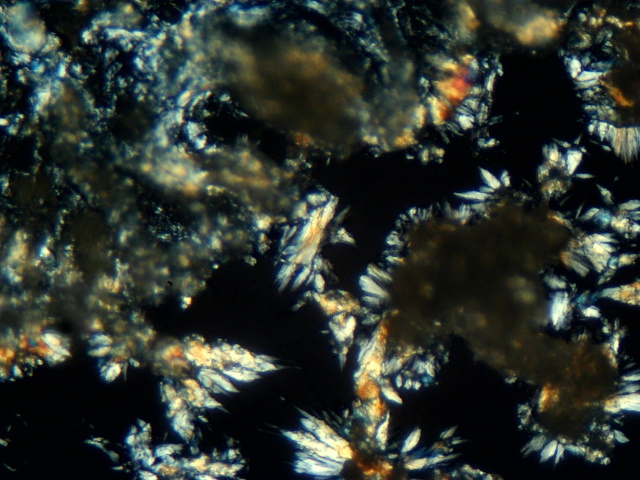 |
|
| Objectief 4x | |
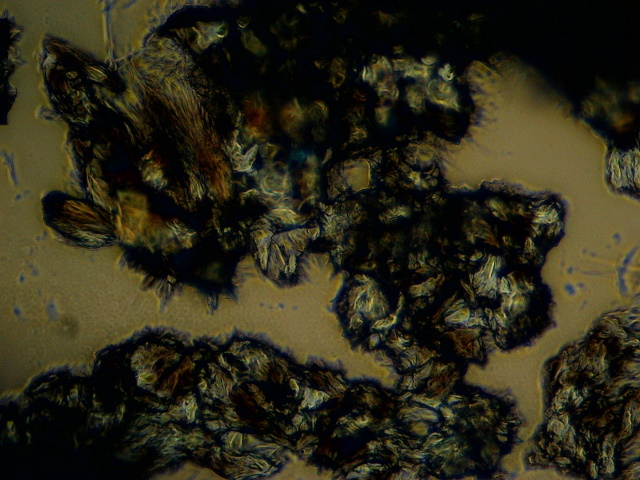 |
|
| Objectief 10x | |
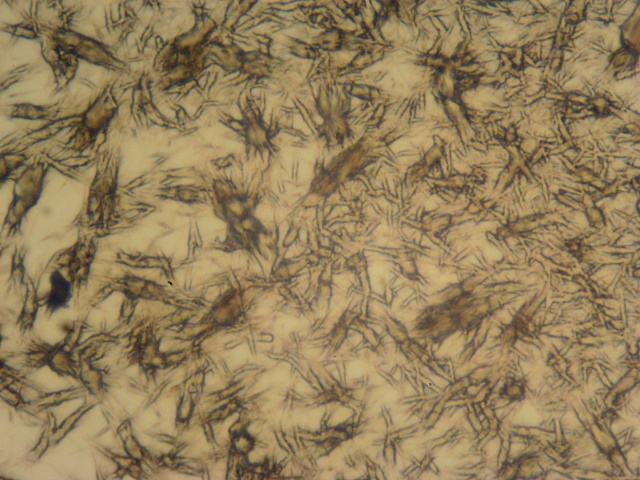 |
|
| Objectief 20x | |
| Dino-Lite | |
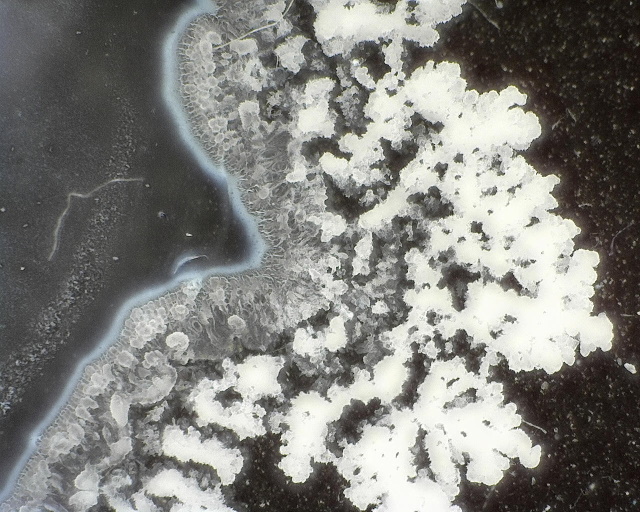 |
|
| Lage vergroting | |
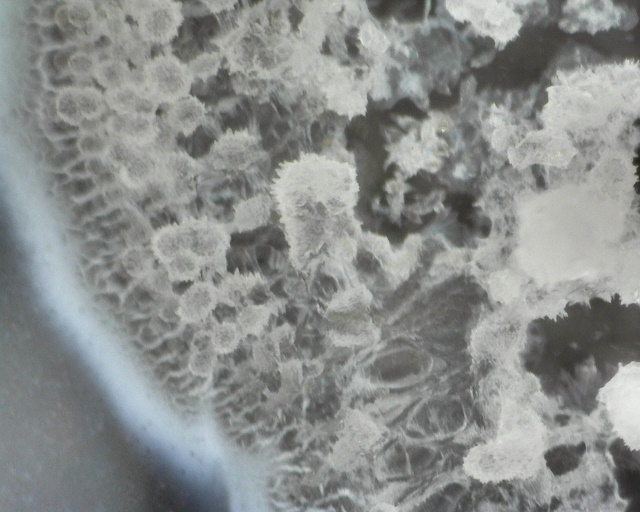 |
|
| Hoge vergroting | |
| Ontledingsreactie | |
 |
|
| Ontledingsproduct calciumacetaat |
 |
| Iodoformreactie: aantonen van aceton | |
 |
|
| Bij zowel het monster als bij aceton (referentie) treedt neerslagvorming op en is de typische ziekenhuisgeur waar te nemen (iodoform) |
|
| Residu analyse | |
|
 |
Discussie:
|
De reactievergelijking: CaCO3 + 2CH3COOH --> Ca(CH3COO)2 + H2O + CO2 |
|
|
Het poeder dat gemaakt is een monohydraat: Ca(CH3COO)2.H2O
|
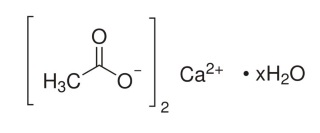 |
| Echt mooie kristallen hebben we niet gemaakt, maar de met de Dino-Lite gemaakte foto's lijken wel op degene die men in het Wikipedia artikel vindt. | |
| Bij elke synthese reactie vraagt men zich af of men inderdaad het gewenste product gevormd heeft. In dit geval controleren we dit door gebruikt te maken van een ontledingsreactie. Bij ontleding van calciumactaat bij 160 °C worden calciumcarbonaat en aceton gevormd. De aanwezigheid van aceton kunnen we aantonen m.b.v. de Iodoform reactie, en zoals uit bovenstaande observaties blijkt wordt inderdaad aceton gevormd. De bellen vorming die ontstaat als we zuur aan het residu toevoegen geeft aan dat er CO2 gevormd wordt, een typerende reactie voor calciumcarbonaat. | |
|
Reactievergelijking:
Ca(CH3COO)2 --DT-->
CaCO3 + CH3-C=O-CH3 |
|
| In het verleden werd de thermische ontleding van calciumacetaat gebruikt om aceton te maken op industriėle schaal. | |
Opmerkingen:
|
|
Literatuur:
Relevante websites: Minder relevante websites:
|
|
Achtergrondinformatie: |
|
Joodoplossing :
- Weeg 1,3 g I2 af in een bekerglaasje. - Voeg 2,6 g KI toe (ongeveer 2 keer zoveel als het I2). - Voeg ongeveer 1,5 mL water toe en zwenk (enkele seconden) tot het jood is opgelost. - Vul aan tot 10 mL. - Deze oplossing moet je voor gebruik verdunnen tot oranje-geel. |
| Iodoform test voor ketonen |
| Reactievergelijking: |
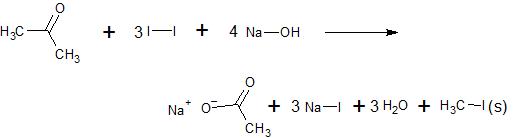 |
| Vorming van het gele vast iodoform is een positief resultaat |
30/09/2019