Synthese van Koper Oxalaat


|
Synthese van Koper Oxalaat |

|

|
Datum: Mei-Juni 2020
Inleiding:
| In het kader van mijn kristallisatie-experimenten besloot ik om koperoxalaat te maken. |
Materiaal:
|
|
|
|
|
| Verwarmingsplaat | Microscoop camera |
| DinoLite AM4815ZT Digitale Microscoop |
 |
Uitvoering:
| Synthese van koperoxalaat | |
|
  |
 |
|
| Afwegen soda | Toevoegen soda |
 |
|
| Afwegen CuO | Afkoelen |
 |
 |
| Affiltreren | Drogen |
| Herkristallisatie | |
|
 |
| Timelapse filmpje kristallisatie | |
|
 |
Resultaten en discussie:
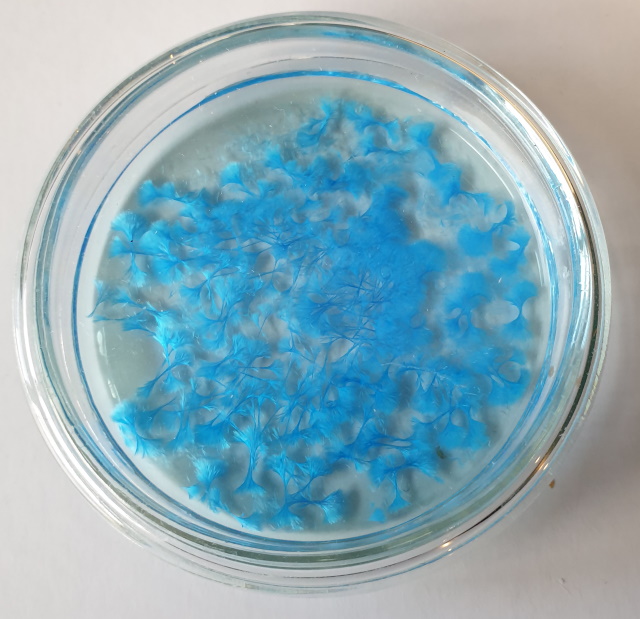
| Koper oxalaat | |
| Zoals men aan onderstaande foto kan zien veranderd de oplossing van kleur, van donkergroen naar helderblauw . | |
 |
 |
 |
 |
|
In deze synthese hebben we het oxaalzuur (H2Ox)
omgezet in het zout natriumoxalaat door de reactie met soda. Het zout hebben
we vervolgens laten reageren met koperoxide. H2Ox + Na2CO3 --> Na2Ox + H2CO3 H2CO3 --> H2O + CO2 (g) Ox2- + Cu2+ --> CuOx (s) Volgens de literatuur is koperoxalaat reukloos en heeft het een blauw-witte kleur. Het is onoplosbaar in water. Koperoxalaat wordt gebruikt als katalysator in organische reacties, |
 |
| Kristalvorming bij het afkoelen tijdens de herkristallisatie | |
 |
|
| Preparaten en resulaat herkristallisatie | |
 |
|
| Microscopische opnames van de kristallen | |
 |
|
| Gepolariseerd | |
 |
|
|
Niet gepolariseerd |
|
| Timelapse filmpje kristallisatie | |
|
Een timelapse filmpje van de kristallisatie
van koperoxalaat. Timelapse filmpje gemaakt met met Dino-Lite AM4815-ZT. Opgenomen: 1 frame/5 s Afgespeeld: 15 FPS Bergroting: ca. 20x |
|
|
YouTube link: Koperoxalaat kristallisatie |
|
 |
|
Discussie:
|
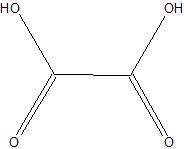
Oxaalzuur H2[O-C(=O)-C(=O)-O] |
 |
|
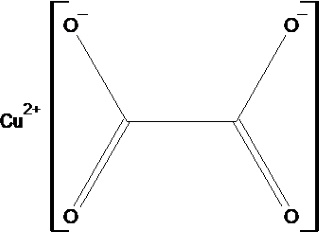
De structuurformule van het vaste koperoxalaat |
 |
| De structuurformule van het koperoxalaat in oplossing is iets complexer |
|
| Opbrengst: | |
|
0.6 g CuO = 0.6/79.545 * 1000 = 7.54 mmol CuO 2.05 g CuOx = 2.05/153.58 * 1000 = 16.278 mmol CuOX Dat zou betekenen dat we meer van een koperverbinding hebben gemaakt dan we als basis gebruikt hebben. Het Handbook of Chemistry and Physics geeft echter een verbinding op die 1/2H2O molecuul bevat met een molmassa van 160.57 g/mol. Dat suggereert dat de verbinding nog niet voldoende gedroogd is. |
|
Opmerkingen:
|
Literatuur:
Relevante websites: Minder relevante websites: |
|
Achtergrondinformatie: |
|
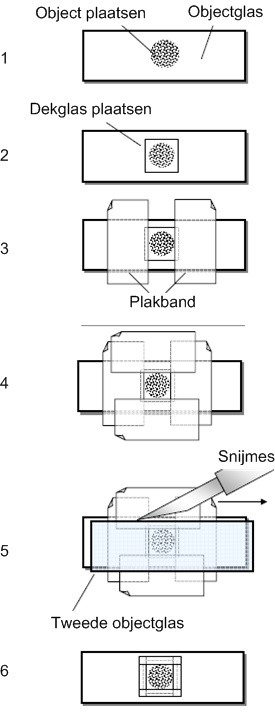
Het maken van een permanent preparaat
|
 |
07/06/2020