Aragoniet synthese ?


|
Aragoniet synthese ? |
 |

|
Datum: November-December 2021
Inleiding:
| Een artikel in NVOX over het veranderen van een op carbonaat gebaseerd mineraal in een kopermineraal leek me interessant genoeg om na te doen. Al doende werd het een ander experiment. |
Materiaal:
|
|
 Mineraalvergruizer |
 Dino-Lite AM4815ZT |
 Mikrochemie kit |
 Zandbad |
Uitvoering:
| Aragonietsynthese | |||
|
 |
||
| Malachietsynthese | |||
|
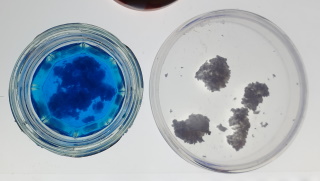 |
||
| Vergruizen | |||
|
 |
||
| Aantonen van acetaat | |||
|
|||
| Meigen's test | |||
|
 |
||
| Zoutzuur test | |||
|
 |
||
|
|||
Resultaten:
| Aragoniet synthese | |
| In eerste instantie kan
men koolzuurvorming waarnemen door de reactie van het carbonaat
met het zuur: CO32- + 2H3O+ <=> 3H2O + CO2 (g) De oplossingen zijn nadat het gas ontweken is nog redelijk helder. Na enige tijd kan men kristalvoming waarnemen De droogkamer is na ca. 5 dagen volledig ingedampt onder vorming van mooie kristallen. |
 |
 |
|
|
|
 |
 |
|
 |
 |
 |
|
| Nemen we een paar van de kleinere kristallen en bekijken we deze onder de Dino-Lite (ca. 30x). | |
 |
|
 |
|
Kristallen blootstellen aan de verzadigde kopersulfaat oplossing |
|
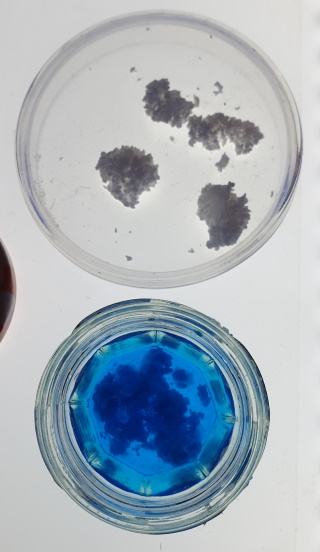 |
19-november 2021
|
| 5-december-2021 | |
 |
|
| 17-december 2021 | |
 |
|
| Het duurde bijna een maand voordat alle vloeistof verdampt was. | |
28-december-2021 |
 |
| Zandsteen als basis | |
 |
|
| Onder de Dino-Lite (~30x) kan men de bolvormige structuur waarnemen. | |
 |
|
 |
|
| Aanzienlijke hoeveelheden niet-gereageerd zandsteen kan men ook nog in het monster vinden. | |
 |
|
| Produkt in kopersulfaat oplossing | |
| Het verzamelde materiaal overgebracht naar een petri-schaaltje. De structuur verschilt duidelijk van het met marmer of zandsteen gemaakte materiaal. | |
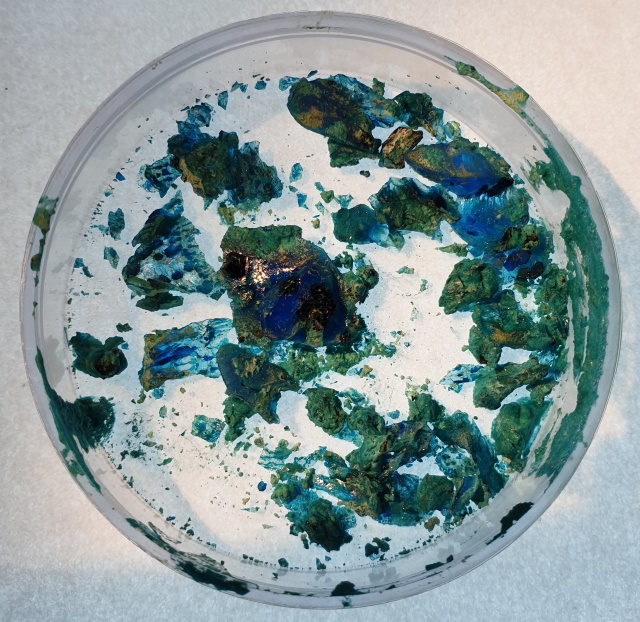 |
|
| In het gedroogde materiaal kunnen we onder de microscoop duidelijk kristallen waarnemen, waarschijnlijk koperacetaat. | |
 |
|
 |
|
Resultaten van de acetaat test |
|
 |
|
| Het mineraal en de natriumacetaat oplossing vormen een roodkleurig neerslag. De azijnzuuroplossing en water vormen geen neerslag. | |
Resultaat van Meigen's test |
|
| Bij het toevoegen van de kobaltnitraat oplossing lost een deel van het materiaal op.Nadat de test was uitgevoerd bleef er eigenlijk alleen maar een blauwachtig neerslag (schijn) achter op de kolf. | |
|
Op de rechtse foto is de lichtblauwe schijn duidelijk waarneembaar |
 |
Zoutzuur test |
|
| Na het toevoegen van de
zoutzuuroplossing lost het mineraal "heftig" op. Kleine belletjes
lijken waarneembaar.
|
 |
| Onder de microscoop is de belletjesvorming (CO2) beter waarneembaar. | 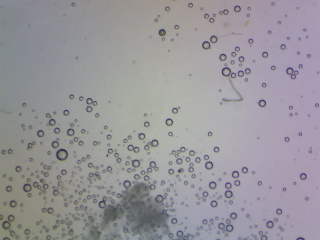 |
| Het koper product laat na toevoegen van HCl nagenoeg geen belletjesvorming zien. | 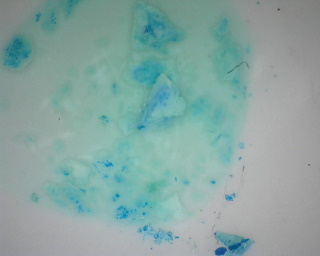 |
Discussie en conclusie:
| In het NVOX artikel neemt de auteur het mineraal Aragoniet (een op calciumcarbonaat, CaCO3, gebaseerd mineraal) en dompelt dit in een sterk geconcentreerde oplossing van kopersulfaat om zo een Malachiet achtig mineraal te maken. Eventueel kan men ook Calciet gebruiken (ook CaCO3). Ik heb een mikrokristal aragoniet gekocht maar vond het een beetje zonde om het voor dit doel te gebruiken. |
 |
| Ik vroeg me af of het
niet mogelijk was om Aragoniet achtige kristallen te synthetiseren
en een beetje Googlen bevestigde dat (Tinkerlab). Ik besloot twee
methodes te gebruiken uitgaande van op calciumcarbonaat gebaseerde
materialen, marmer en zandsteen. Het zandsteen wilde ik
uitproberen om te kijken of de kristallen die gevormd worden op de
Aragoniet van Marokko gaan lijken.
Logischerwijs zou het reactiechemie dan als volgt moeten verlopen:
Het met CO2 verzadigde en geneutraliseerde water zou dan weer carbonaat moeten vormen.
Bij indampoen kan echter ook nog een andere reactie plaatsvinden nl de vorming van calciumacetaat.
En ik kan me niet goed voorstellen waarom deze laatste reactie niet zou plaatsvinden. Het mineraal aragoniet is een calciumcarbonaat met chemische formule CaCO3. Het is een metastabiele polymorf van calciet en is daardoor moeilijk te onderscheiden van calciet, omdat de chemische eigenschappen weinig verschillen. Gegeven de chemische samenstelling van aragoniet is het onwaarschijnlijk dat we zuiver aragoniet maken m.b.v. de beschreven methode. |
| Zoals in de foto's te zien is lijkt de op marmer gebaseerde methode mooie Aragoniet kristallen te vormen, althans in eerste instantie lijkt er een overeenkomst te zijn met foto's die ik Googlend vind. Gaat men echter in meer detail kijken dan ziet men grote verschillen. Zoals reeds aangegeven vraag ik me dan ook af of ik hier meer met een mengsel van calciumcarbonaat en calciumacetaat te maken heb. Op zich is het met de mij ter beschikking staande apparatuur niet goed mogelijk om dat te controleren. Wat we echter wel kunnen doen is kijken of er geschikte aantoningsreacties zijn. Literatuuronderzoek lijkt dan een drietal mogelijkheden te geven. |
| Aantonen van acetaat door een reactie met geneutraliseerd IJzerchloride waarbij een rode kleur gevormd wordt: |
| Fe3+ + 3CH3COO- -> (CH3COO)3Fe (s) |
| De acetaat test laat duidelijk zien dat er inderdaad acetaationen aanwezig zijn in het mineraal. De vergelijkingstest met azijnzuur in combinatie met de water blanco geeft aan dat het azijnzuur in het mineraal volledig geneutraliseerd is. |
| In de literatuur
wordt gesproken over een test met Feigl's oplossing. Als een
monster aragoniet in een Feigl oplossing wordt geplaatst dan zal
het binnen 30 minuten zwart kleuren. Calciet heeft 10x langer
nodig. Feigl's oplossing wordt echter gemaakt van Mangaansulfaat
(12g) and Zilversulfaat (1g) opgelost in 100 ml demi-water.
Chemicaliën die ik niet tot mijn beschikking heb.
Al zoekende kwam ik echter een andere test tegen nl. Meigen's test. Als we met argoniet te maken hebben zal het mineraal roze kleuren. Calciet en dolomiet blijven wit gekleurd of kleuren lichtblauw. Cobaltnitraat had ik wel in mijn bezit dus voor mij was het moment aangebroken om mijn mikrochemie kit uit de kast te halen. Zoals vermeld was een van de eerste zaken die me opviel bij het uitvoeren van dit experiment dat een deel van het mineraal oploste. Nadat de test was uitgevoerd bleef er eigenlijk alleen maar een blauwachtig neerslag achter op de kolf. Het resultaat suggereert dat er geen argoniet gevormd is maar wel een calciumcarbonaat. Dat we met carbonaten te maken hebben kunnen we eenvoudig aantonen m.b.v. de zoutzuur test. We nemen waar dat het materiaal snel oplost onder vorming van kleine gasbellen. Een reactie met kalk voorloopt meestal wat heftiger, hetgeen suggereert dat de hoeveelheid calciumcarbonaat in het monster niet erg hoog is. Al met al lijkt de conclusie gerechtvaardigd dat we geen aragoniet gemaakt hebben maar een mengel van calciumcarbonaat en calciumacetaat, voornamelijk calciumacetaat. Brengen we het gevormde materiaal in contact met water dan blijkt het grootste deel, afgezien van wat poeder en niet gereageerd marmer, oplosbaar te zijn in water, hetgeen bevestigd dat we voornamelijk calciumacetaat gemaakt hebben aangezien calciumcarbonaat onoplosbaar is in water. Indien we de gemaakte
koperverbinding blootstellen aan zoutzuur zien we nagenoeg geen
belletjesontwikkeling, hetgeen aangeeft dat we ook hier met een
acetaatverbinding te maken hebben. |
Conclusies:
|
Opmerkingen:
|
Literatuur:
Relevante websites:
Minder relevante websites |
Achtergrondinformatie: |
| Calciumcarbonaat (CaCO3), meestal
kalk genoemd, is een van die materialen dat zich op verschillende
manieren manifesteert. Zeer bekend zijn marmer en schelpen maar in
de natuur vindt men het ook vaak als het mineraal calciet
(kalkspaat). Normaal gesproken is het kleurloos of wit maar als er
kleine verontreinigingen en/of metaaloxides in het materiaal
zitten kan het een roodachtige, roze, paarse of bruinachtige kleur
krijgen (denk aan de verschillende soorten marmer).
De heldere kristallen hebben nog een speciale eigenschap en dat is dat ze dubbelbreking (Engels: birefringence) vertonen, in die vorm noemt men ze ook wel dubbelspaat (Engels: Iceland spar). Het effect dat dubbelbreking heeft kan men op bovenstaande foto zien. Men ziet de woorden die op de onderliggende tekst vermeld staan dubbel. |