Vergelijken warmteopname water vs zonnebloemolie


|
Vergelijken warmteopname water vs zonnebloemolie |

|

|
Datum: Januari 2022
Principe:
| Effect van het verschil in soortelijke warmte van vloeistoffen bestuderen en hoe dit een meting kan be´nvloeden. |
Materiaal:
|
 |
|
|
CMA CoachLab Temperatuursensor |
Uitvoering:
|
|
| Exp 1-3 | Exp 4 |
 |
 |
|
|
|
| Screenshot | |
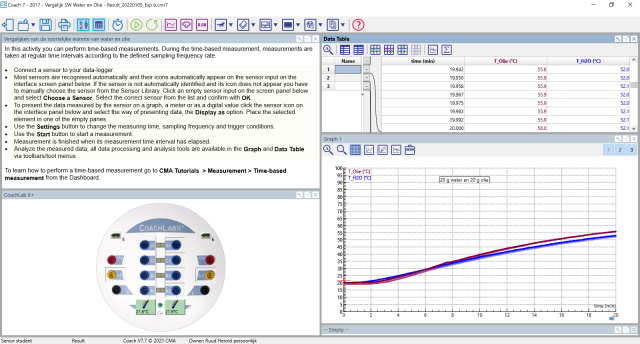 |
|
Resultaten:
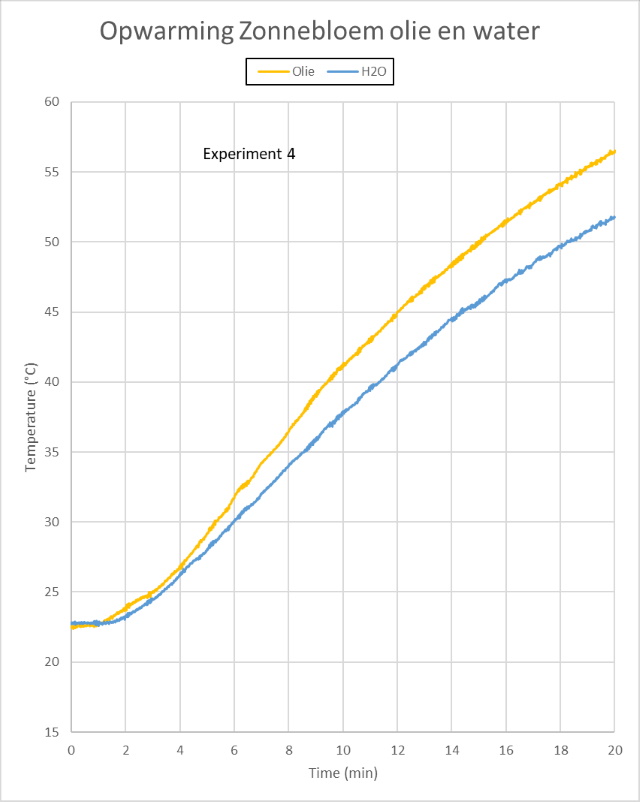
| De meetresultaten van de eerste drie experimenten zijn ge´mporteerd in Excel en gemiddeld. Vervolgens kan men onderstaande grafiek construeren. |
|
|
| Experiment 4 |
 |
Discussie:
| Als warmte naar een
voorwerp stroomt, neemt de temperatuur van het voorwerp toe (aangenomen
dat er geen faseovergang plaatsvindt). De hoeveelheid warmte Q (in
Joule, J) die nodig is om de temperatuur van een bepaald materiaal te
verwarmen is evenredig is met de massa m (in kg) van het aanwezige
materiaal en de temperatuurverandering ∆T (K of ░C). In formule: Q = m.Cp.∆T Hierin is Cp (in J/kg.K) de warmtecapaciteit van het voorwerp gedefinieerd als de hoeveelheid warmte (energie) die aan een voorwerp moet worden toegevoerd om de temperatuur van het voorwerp 1 Kelvin te doen stijgen. In dit geval gebruiken we de Cp omdat we de druk constant te houden. De warmtecapaciteit van een vloeistof is licht afhankelijk van de temperatuur van die vloeistof. Als men het volume constant houdt spreekt men van Cv. Elke stof heeft een eigen warmtecapaciteit (specifieke warmtecapaciteit). Voor globale energiesysteemanalyses kan de warmtecapaciteit constant worden verondersteld, maar bij gedetailleerde ontwerpberekeningen moet de temperatuursafhankelijkheid uiteraard meegenomen worden. Een andere benaming voor de specifieke warmtecapaciteit is de soortelijke warmte. Voor water bij 1 bar en temperaturen
tussen 20 en 60 ░C bedraagt de specifieke warmtecapaciteit ca. 4.18
kJ/kg.K. Voor zonnebloemolie bedraagt de specifieke warmtecapaciteit ca.
2.25 kJ/kg.K. Als we dan aan beide stoffen dezelfde hoeveelheid warmte
toevoegen (door ze bv naast elkaar op een kookplaat te zetten), dan zal
de stof met de lagere soortelijke warmte een grotere DT bereiekn en dus
ook sneller opwarmen. Exact dat kunnen we waarnemen in de grafiek, aan
het eind van het experiment heeft de olie een hogere temperatuur bereikt
als het water. |
|
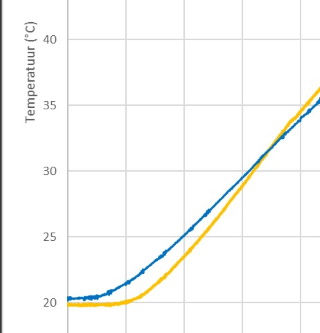
| Bekijken we de grafiek echter
nauwkeurig dan zien we dat in het eerste deel van de grafiek het water
sneller opwarmt dan de olie. Als we de data van elk experiment bekijken
dan vinden we deze observatie ook in de individuele experimenten terug. De verklaring voor deze observatie kan men vinden in het mechanisme voor warmteoverdracht in vloeistoffen, nl voornamelijk door convectie (vloeistofstroming) en de mate van convectie wordt bepaald door de viscositeit van een vloeistof. Water heeft een lage viscositeit en stroomt gemakkelijk, terwijl olie met een hogere viscositeit moeilijker stroomt. Als we nu de bodem van het vaatje verwarmen kost het relatief meer tijd voor de warme olie om de temperatuursensor te bereiken, waar we de temperatuurtoename meten. Voor water verloopt het proces sneller. Daarom zal men voor water sneller een temperatuurtoename registreren dan voor olie waarna het effect teniet gedaan wordt door de snellere temperatuurtoename van de olie. |
 |
| Bovenstaande verklaring kunnen we experimenteel aantonen door de temperatuursensors dichter bij de bodem te plaatsen zoals we Experiment 4 gedaan hebben. Het effect van de stromingsverschillen is veel minder aanwezig en de olie warmt daar sneller op zoals men kan zien in nevenstaande grafiek. | 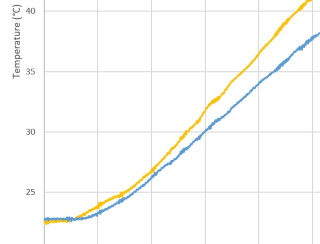 |
Opmerkingen:
|
Literatuur:
|
Relevante websites:
Minder relevante website: |
Achtergrondinformatie:
|
De warmteafgifte of warmteopname q naar of van een massa m is gerelateerd aan de te temperatuursverandering ∆T volgens: q = Cp.m.∆T waarbij Cp de specifieke warmte capaciteit van die massa is bij constante druk. Voor water: Cp = 4.18 J/(g.░C) |
06/01/2022