De magie van Plasma & GaNs volgens Silvia Hoevenaar


|
De magie van Plasma & GaNs volgens Silvia Hoevenaar |

|

|
Datum: December 2022 - Januari 2023
Inleiding:
|
Voor een aantal sceptici is Silvia Hoevenaar ((SH) mogelijk al een
bekende aangezien ze door de Vereniging tegen de Kwakzalverij (VtdK) al
eens voor het voetlicht is gebracht met haar kwakzalverij [1,2].
Recentelijk is ze met iets nieuws begonnen, de “Plasma GaNs therapie”.
Op haar facebookpagina kun je zien wat het maken van dat spul dat
inhoudt. In lezingen en workshops die ze geeft over plasma en GaNs
vertelt ze hoe je het maakt en krijgt men ook een setje om het te maken
[3]. Ik citeer de omschrijving die ze geeft over haar workshop:
“Plasma en gans kunnen je leven een heel stuk verbeteren. Je gezondheid, je emoties, je planten, dieren, je landbouw, je elektrarekening en nog veel meer. Op deze uitgebreide lezing leer je alles over hoe je plasma geactiveerd water kunt inzetten en wat je nodig hebt om het zelf te maken, maar vooral hoe het werkt. In 3 uur tijd weet je heel veel over plasma dat je daarna 100% door wilt om het zelf te leren maken. Plasma is een 4e staat van materie en werkt in de energie als de bouwsteen van het universum. Deze flow van magnetische en zwaartekrachtvelden, hebben een impact op alles wat uit balans is en kunnen dat weer herstellen als je gebruik maakt van plasma. Gans is een vorm van een oneindige energie bron die via een soort alchemistisch proces wordt opgewerkt wat een uitwerking heeft op alles waar je het voor gebruikt en water kan je daarmee activeren tot plasma water. Wat zelfs al onderzocht wordt door de Radboud Universiteit, Erasmus en Wageningen Universiteiten in de werking hiervan op gezondheid en landbouw.” Je kunt dan onderstaande plaatjes vinden op de facebook pagina’s. |
|
 |
 |
|
Als chemicus zeg je dan dat je gewoon naar een elektrochemische cel zit
te kijken, maar dat heb ik schijnbaar verkeerd begrepen. In de chemie
spreken we van een elektrochemische cel als we elektrische energie
gebruiken om de redox reactie aan te drijven. Volgens haar gaat het hier
om “Koper GaNs CUO” en wederom citerend:
“Als je werkt met plasma en GaNs, neemt je lichaam op wat het nodig heeft en daardoor kan je nooit een teveel van deze soorten plasma binnen krijgen. Je kan deze vorm van heling zelf maken via een proces om plasma geactiveerd water te maken.” Ze adviseert om de neergeslagen zouten (GaNs) die ontstaan bij de elektrolyse alleen in kompressen op te nemen (“GaNs gebruik je in Kompressen of in de buisjes die je in je drinken doet.”) Ze raadt wel aan de oplossing (het plasma), verder verdund, te drinken (“Drink NOOIT de GaNs maar alleen de plasma!”). Wederom een wondermiddel dus. Het blijft trouwens niet bij koper alleen, schijnbaar worden er meer typen cellen behandeld, elk natuurlijk zijn eigen wondermiddel. |
|
 |
|
|
Probeer je te begrijpen hoe zij deze cellen zien dan kun je vooral
herkennen dat ze basis natuur- en scheikunde totaal niet begrijpen en er
een heel aparte draai aan geven. Vooral het begrip energie wordt weer
aardig misbruikt. Ter illustratie een klein stukje uit een post van een
aanhanger die door SV werd omschreven als “Zo mooi dit.”
“Als je ook atomen wilt gaan afkoelen kwamen ze erachter, als dit naar nul graden toe moest dan was hiervoor extra energie nodig. Extra energie wat meer was dan de berekeningen om deze 0 graden te bereiken. Want zoals bleek als ze dit niet deden dan maakte de atomen uit zichzelf warmte aan waardoor de 0 graden niet werd bereikt. Waar haalde deze atomen dan hun energie vandaan?” |
|
|
Je vraagt je af wat deze mensen op de middelbare school gedaan hebben alwaar hun toch een minimale basiskennis van natuur- en scheikunde onderwezen werd. Dat stukje op zich is al een omkering van de werkelijkheid. Op de weg naar het absolute nulpunt (0 K, -273.15 °C) onttrek je juist energie uit het systeem. De warmte (energie) die de atomen en moleculen vertegenwoordigen is in feite de gemiddelde snelheid waarmee ze staan te trillen. Door energie te onttrekken vindt er steeds minder beweging plaats tot je het absolute nulpunt bereikt. De observatie die dan gedaan wordt is dat er bij die temperatuur nog altijd een minimale vorm van beweging is (nulpuntsenergie). Ook wordt een en ander over plasma beweerd waarbij onderstaande “definitie” gegeven wordt. “Plasma is een 4e staat van materie en werkt in de energie als de bouwsteen van het universum. Deze flow van magnetische en zwaartekrachtvelden, hebben een impact op alles wat uit balans is en kunnen dat weer herstellen als je gebruik maakt van plasma. Gans is een vorm van een oneindige energie bron die via een soort alchemistisch proces wordt opgewerkt wat een uitwerking heeft op alles waar je het voor gebruikt en water kan je daarmee activeren tot plasma water. Wat zelfs al onderzocht wordt door de Radboud Universiteit, Erasmus en Wageningen Universiteiten in de werking hiervan op gezondheid en landbouw.” In de natuurkunde wordt onder plasma een fase verstaan waarin de deeltjes van een gasvormige stof enigszins geïoniseerd zijn. Vaak wordt plasma de vierde aggregatietoestand genoemd, naast vast, vloeibaar en gas[4]. De overgang van gas naar plasma is echter geheel continu. In feite is gasvormig plasma simpelweg de bekendste vorm, en bestaat plasma ook in de andere fasen. De meeste van ons kennen plasma waarschijnlijk van de plasmalampen, die niet gebruik maken van warmte of een alchemistisch proces [5]. |
|
 |
 |
|
Interessanter vond ik onderstaande citaat. “Volgens Mehran Keshe die een nucleair ingenieur is en al vele jaren onderzoek doet naar plasma technologie en wetenschap, is ervan overtuigd, dat je 99% van alle ziektes kunt hele door gebruik te maken van plasma. Deze kennis en info deel ik jou graag omdat er veel meer mogelijk is dan de meeste mensen denken of kunnen beseffen. Open je mind en kom luisteren naar deze magie van plasma en gans!” Er wordt hier verwezen naar de Keshe foundation waarop dit GaNs geleuter dan gebaseerd is [6]. De Keshe Foundation claimt dat ze werkt aan het ontwikkelen van nieuwe wetenschappelijke inzichten en technologieën die dan leiden tot allerlei Science Fiction achtige toepassingen. Volgens de website gaat het dan meer specifiek over het ontwikkelen van “Plasma Science” in de vorm van speciaal ontwikkelde “Plasma reactors” en andere apparaten. De naam Mehran Keshe kwam mij echter bekend voor en na wat gespit in mijn archief vond ik een artikel uit 2007 in Elektuur, een tijdschrift over elektronica, getiteld ”Message in a bottle – Speurtocht naar de Holy Graill – vrije energie” [7]. Het artikel beschrijft een gesprek met Mehran Keshe die met een Cola fles met wat elektroden en een vloeistof erin in feite claimt een energetische Perpetuum Mobile ontwikkeld te hebben. Ik wil dit artikel niet in zijn geheel hier bespreken maar een tweetal citaten zegt genoeg. “De fles draagt het geheim van de toekomst van energievoorziening van de wereld in zich. En passant levert deze fles ook de oplossingen voor het CO2 probleem, …. “Volgens Keshe zijn op dit moment een aantal instituten en universiteiten zijn vindingen aan het onderzoeken en laten terughoren dat het tot nog toe allemaal lijkt te kloppen. De tijd al het leren. “ Citaten die dus heel herkenbaar overkomen en keer op keer op diverse plaatsen door de jaren heen herhaald worden. Er wordt met namen van Universiteiten gestrooid maar zonder echte contactinformatie te geven. Maar de observatie dat het artikel uit 2007 is en we ondertussen al in 2023 leven zegt in feite genoeg. |
|
De echte vraag waar we als scepticus mee worstelen is of het drinken van
de geproduceerde vloeistof (al dan niet verdund) gevaarlijk kan zijn, bv
doordat we teveel koper in ons lichaam opnemen. Koper is een
sporenmineraal dat nodig is bij de vorming van bindweefsel en botten.
Het zorgt ook voor de vorming van pigment van het haar, een goede
werking van het afweersysteem en de bloedstolling en is betrokken bij de
overdracht van zuurstof (oxidatiereacties). Koper kan zich opbouwen in
de zachte weefsels van lever en de metabole vermogens van de lever om
het bloed te ontgiften en te reinigen verstoren. Het is van belang zich
te realiseren dat als het om metabolische effecten gaat dan spelen
koperionen een rol (Cu2+) en (meestal) niet koper metaal (Cu). Om die
vraag te beantwoorden kunnen we wat experimenten uitvoeren waarbij we de
gepresenteerde cellen kopiëren en analyseren. Op facebook vinden we dat
voor het bouwen van een cel de volgende materialen benodigen[3]:
Alvorens de uitgevoerde experimenten te bespreken is het verduidelijkend om de basis van de elektrochemie kort te bespreken [8,9,10]. Om elektrodeprocessen te kunnen bestuderen maken we gebruik van een elektrochemische cel. Deze bestaat in zijn eenvoudigste vorm uit twee geleiders (elektroden) geplaatst in een vat gevuld met elektrolytoplossing (meestal een anorganisch zout). Bij stroomdoorgang door een dergelijke cel vinden aan de elektroden reacties plaats waarbij de lading in de vorm van elektronen of ionen het grensvlak elektrode/oplossing of oplossing/elektrode passeert. De elektrode waaraan oxidatie plaatsvindt wordt anode genoemd, de elektrode waaraan reductie plaatsvindt heet kathode. Voor de anodische (+ pool) reactie kunnen we schrijven (e = elektron): red1 <=> ox1 + n e Voor de kathodische reactie (- pool): ox2 + m e <=> red2 De bruto celreactie wordt dan: m red1 + n ox2 <=> m ox1 + n red2 Stroomdoorgang kan alleen plaatsvinden indien er een gesloten circuit bestaat hetgeen men bereikt door beide elektroden uitwendig met elkaar verbinden. Levert een elektrochemische cel bij het tot stand komen van dit elektrisch contact spontaan stroom, dan spreken we van een galvanische cel (accu). Indien daarentegen een uitwendige spanningsbron (bv. batterij) moet worden aangesloten om stroom door de cel te doen vloeien, dan spreken we van een elektrolytische cel. Hierbij wordt elektrische energie omgezet in chemische energie. De celreactie verschilt alleen daarin van een normale redoxreactie in oplossing, dat de elektronen nu niet direct van het ene deeltje op het nadere worden overgedragen maar via een uitwendig circuit. Een eerste opmerking die ik wil maken is dat als men twee koper elektrodes gebruikt in combinatie met een batterij, in normaal gebruik, te maken krijgt met elektrodepositie, in dit geval verkopering (elektroplating). Als men echter als doel heeft om een object te verkoperen gebruikt men kopersulfaat (CuSO4.5H2O) als zout en niet keukenzout (NaCl). |
|
Materiaal:
|
|
Opstelling en uitvoering:
| Bouw de opstelling op zoals weergegeven in onderstaande figuur en foto. Met deze opstelling monitoren we het elektrolyseproces. |
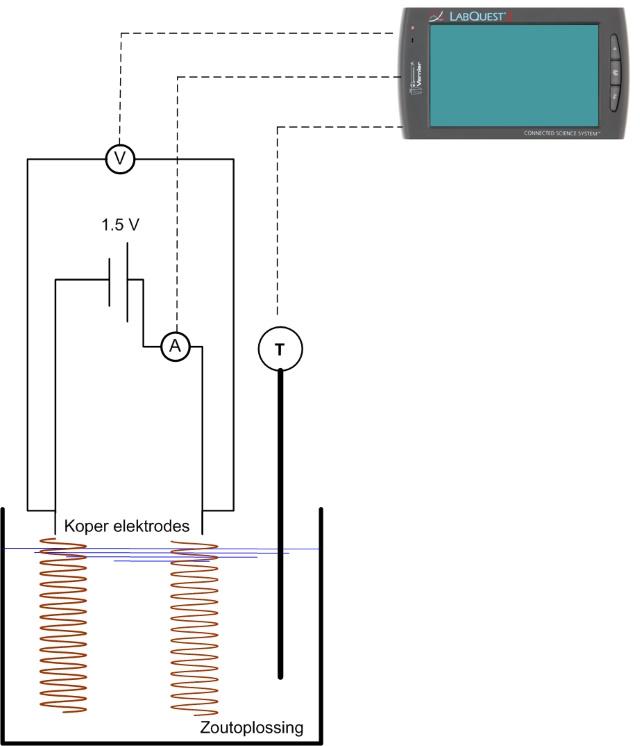 |
 |
|
Experimenten: Uitvoering en Resultaten:
| Experiment 03012023: identieke koper elektrodes | |
|
|
| Meetresultaten: | |
|
De meetresultaten van het eerste experiment
zijn gevisualiseerd in onderstaande figuur en laten zien dat de cel
gefunctioneerd heeft en dat er elektronen/ionentransport heeft
plaatsgevonden.
|
|
| Visuele observaties: | |
|
De pH van de oplossing na elektrolyse was ca. 8 (gemeten met pH papiertje) Na affiltreren en drogen: 375 mg koper teruggewonnen (bakje is 600 mg) Koper blijft achter in het papier |
|
|
|
|
|
|
|
| Ingedampte preparaten (objectief 4x) | |
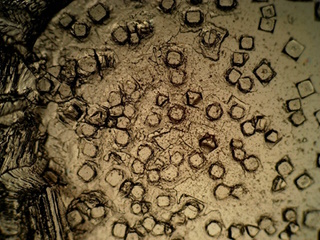 Licht |
 Licht |
 |
 |
| Gepolariseerd | Gepolariseerd |
| Voor bezinken: Zoutkristallen Koper is duidelijk waarneembaar |
Na bezinken: Zoutkristallen |
| Microscopisch onderzoek van de ingedampte oplossing bevestigd dat we na bezinken voornamelijk met een zoutoplossing te maken hebben. | |
| Elektrodes | |
 |
 |
| Elektrodes nat (links + pool, rechts – pool) | Elektrodes (droog) |
 |
 |
| USB microscoop ca. 50x, + pool | USB microscoop ca. 50x, - pool |
| Visuele inspectie laat een verruwing van het oppervlakte van de anode zien. | |
| Weegcijfers: | |
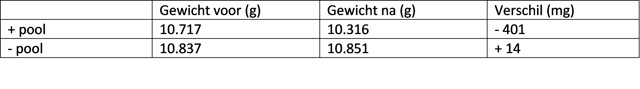 De weegcijfers laten zien dat de anode massa heeft verloren, terwijl de kathode pool mogelijk een minieme hoeveelheid massa heeft opgenomen. Gebaseerd op deze cijfers blijft slechts maximaal 6% van het geproduceerd koper achter in de oplossing. In werkelijkheid zal dit getal lager zijn aangezien een deel achterbleef op het filter. |
|
| Discussie: | |
|
De basisvoorstelling cel kunnen we schrijven
als: Cu | Na+ (1.7 M) || Cl- (1.7 M) | Cu 10% NaCl oplossing = 10 g NaCl/100 g water = 10/58.44*10 mol/l = 1.7 M Deze cel zit wat complexer in elkaar dan ik in eerste instantie dacht. Ik dacht met een elektrodepositie (elektroplating) systeem te maken te hebben, maar dat is niet zo. Bij elektroplating zou koper moeten neerslaan op de kathode maar dat observeren we niet echt. |
|
|
|
|
|
Bij elektroplating zouden we met onderstaande
reacties te maken hebben, waarbij men dan een kopersulfaat oplossing
gebruikt i.p.v. een natriumchloride oplossing.
Anode (+): Cu <=> Cu2+ + 2e- Kathode (-): Cu2+ + 2e- <=> Cu (s) Het gevormde koper zet zich echter niet vast op de kathode maar slaat neer in de oplossing als bruin/oranje poeder. De afwijkende reactie is dan waarschijnlijk te herleiden naar de gebruikte zoutoplossing. Het zout vormt Na+ en Cl- ionen waarbij de Na+ ionen zich naar de kathode (negatief) bewegen en de Cl- ionen naar de anode (positief). De migrerende ionen dragen de lading door de oplossing en zorgen er zo voor dat het elektrische circuit gesloten wordt. Op basis van de aanwezige componenten kunnen we de volgende potentiële halfwaarde reacties formuleren (met hun standaard potentiaal): |
|
|
|
Deze reactie selectie zullen we moeten
combineren met de volgende waarnemingen:
Zodra stroom gaat lopen door de oplossing gaat lopen wordt koper geoxideerd (elektronen worden onttrokken) aan de kathode (+) en gaat in oplossing. De koperionen diffunderen door de oplossing naar de anode (-), waar ze elektronen teruggeven aan het koper metaal door op de elektrode neer te slaan. Daar vallen (afbladeren) ze van af en zwerven dan door de oplossing waardoor deze oranje/bruin kleurt. De observaties geven ook aan dat water gereduceerd wordt tot H2 gas en OH- (hydroxide ionen) waardoor de oplossing alkalisch wordt. Dat suggereert dat mogelijk ook koperhydroxide (Cu(OH)2) gevormd kan worden. Koperhydroxide lost nagenoeg niet op in water en vormt dan een blauw, volumineus precipitaat, hetgeen niet geobserveerd is. Koperhydroxide is wel oplosbaar is in geconcentreerde loogoplossingen, hetgeen die oplossing dan blauw kleurt, maar een pH van 8 geeft aan dat de oplossing niet extreem basisch is. Andere kopercomplexen die eventueel gevormd zouden kunnen worden zoals koperchloride (CuCl2) zijn vaak in water oplosbaar en zouden ook de oplossing blauw moeten kleuren (Oplosbaarheid: 75.7 g/100 mL (25 °C)). De vorming van een blauwkleurig neerslag en een blauwe oplossing hebben we echter niet duidelijk waargenomen. Een andere mogelijkheid is de vorming van chloorgas (Cl2) aan de anode (+), maar het gevormde chloor zal het koper oxideren naar Cu2+. Er vormt zich dan langzaam koperchloride hetgeen tot blauwkleuring van de oplossing zou moeten leiden. Op het oog lijkt het gemakkelijker om water te oxideren (E0 = -1.23 V) dan Cl- ionen (E0 =-1.36 V). De cel zal echter nooit standaard-state condities bereiken, het zout is verdund in water hetgeen de benodigde potentiaal om het Cl- te oxideren reduceert, de pH van de cel is echter > 7 hetgeen de oxidatie potentiaal van water reduceert. De bepalende factor is echter de benodigde overpotentiaal, hetgeen het extra voltage is dat benodigd is om de reactie te laten verlopen met dezelfde snelheid als het in een ideaal systeem zou verlopen. Onder ideale omstandigheden zou een potentiaalverschil van 1.23 V voldoende zijn om water te oxideren naar zuurstofgas . In werkelijkheid is een veel groter voltage nodig, waarbij een overpotentiaal van 1V benodigd is. De vorming van choorgas zou ook impliceren dat er natriumhypochloriet (bleek) gevormd wordt volgens:
De vorming van Natrium als metaal op de kathode benodigd meer spanning dan de batterij (1.5 V) kan leveren, nog afgezien van de benodigde overpotentiaal, hetgeen betekent dat we deze mogelijkheid kunnen uitsluiten. Deze nogal uitgebreide analyse van de cel is gemaakt om te laten zien dat het systeem volledig elektrochemisch verklaarbaar is zonder een beroep te hoeven doen op plasmaverschijnselen of alchemische transmutaties. |
|
| Nanocoating experimenten | |
| Facebook geeft aan dat ze natronloog/kaliloog gebruiken. | |
| Als eerste experiment een aantal reageerbuizen gevuld met een stukje koper en verschillende oplossingen. Na een dag was echter geen "coating" gevormd. | |
 |
|
|
Ik vroeg me vervolgens af of ze geen "verdigris" coating gemaakt hadden
zoals beschreven in: Bereiding van de op koper gebaseerde pigmenten Malachiet en Verdigris Verdigris werd in het verleden gemaakt door een groene korst van koperplaten af te schrapen nadat deze blootgesteld was aan azijn en wijn dampen. Experimenten waarbij we koperdraad blootstellen aan azijnzuur dampen. |
|
|
|
|
|
Reactie: Cu + 2HAc + H2O <=> Cu(Ac2) + 2H3O+ We krijgen wel een mooie groene coating maar de kleur wijkt teveel af van wat we waarnemen op de site. Het gevormde koperacetaat is oplosbaar in water en zou dus gelijk verdwijnen als we het in een cel stoppen. |
|
| Zink en Caustic | |
|
Bij nadere bestudering van de facebook pagina's vinden we: “Kan iemand mij een beetje meer informatie geven rond nanocoating met caustic soda? “ “Als de caustic soda 2 dagen staat met spiralen en een paar zink plaatjes, moeten de spiralen dan al helemaal zwart zijn of komt dat later tijdens het droogproces? Als ze wel helemaal zwart zouden moeten zijn, wat heb ik dan fout gedaan.” “Ja het duurt een paar dagen dat het zwart is. Eerst stomen een dag. En daarna verder stomen op een warmte bron is goed. Zoals een kachel bijvoorbeeld. Dan gaat het proces verder en wordt het zwart” Op basis daar van kunnen we een experiment formuleren:
|
|
 Start |
 Na enkele dagen is een grijze laag afgezet. Waterstofvorming is duidelijk waarnmeembaar |
 Voor spoelen |
 Na spoelen |
| Deze observaties in combinatie met de informatie op Facebook suggereren dat dit inderdaad de juiste nanocoating methode is die we kunnen gebruiken om "genanocoate" alectrodes te maken. In onderstaande foto's kan men het proces waarnemen. | |
 |
 |
| Begin | Na enkele dagen |
|
In het experiment is een koperen spiraal in
een sterk basische oplossing geplaatst, door daar de nodige korrels
gootsteenontstopper (NaOH) in te stoppen en op te lossen. Vervolgens zijnk
enkele zink pellets toegevoegd en daarbij opgelet dat het zink in contact
kwam met het koper. Zoals men in Figuur 7 kan zien kleurt het koper zwart en
kan men gasbelletjesvorming zien. De basischemie van deze reactie is bekend.
Zink (Zn) reageert met Natriumhydroxide (NaOH) en vormt natriumzinkaat (Na2ZnO2,
Natrium zinkoxide) en waterstof (H2). Reactie: Zn + 2H2O + 2NaOH → Na2Zn(OH)4 + H2
Zn(s) + 2OH- (aq) ⇔ZnO22- (aq) + H2 (g) Het zink wordt geoxideerd naar het zinkaat ion en de hydroxide ionen worden gereduceerd naar waterstof. Indien koper in contact komt met het zink ontstaat een elektrolytische cel en vindt elektronentransport plaats (stroom) van het zink naar het koper. Op het oppervlakte van het koper zullen de elektronen het zinkaat reduceren volgens: ZnO22-(aq) + 2H2O(l) + 2e → Zn(s) + 4OH-(aq) Op het oppervlakte van het zink worden de verloren elektronen gecompenseerd door het produceren van zinkaat: Zn(s) + 4OH-(aq) → ZnO22-(aq) + 2H2O(l) + 2e Dit is dus een meer klassieke galvaniseringsreactie waarbij zink neerslaat op het koper. Op deze manier produceren we dus een “genanocoate” koperelektrode die we in een experiment kunnen gebruiken. |
|
| Experiment 15012023: "genanocoate" anode | |
| In dit tweede experiment is de “genanocoate” koperelektrode verbonden met de anode (+ pool) en de koperelektrode met de kathode (-pool). | |
| Meetresultaten: | |
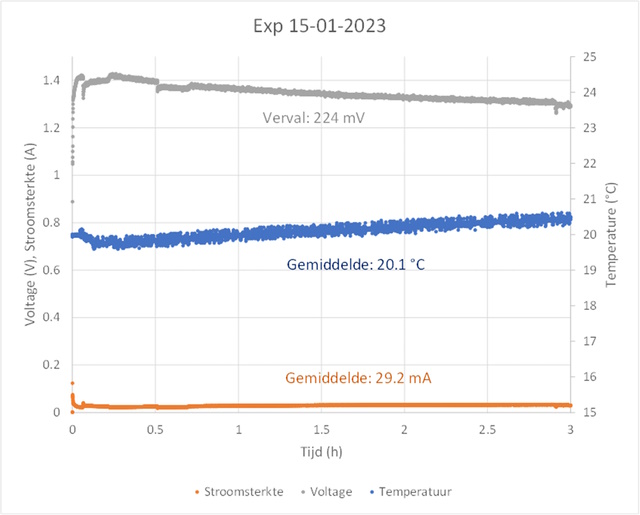 |
|
| Visuele observaties: | |
| Onderstaande figuren laten zien dat deze men deze cel hetzelfde gedrag vertoont als in het eerste experiment. In dit experiment werd ook een zweem blauwkleuring waargenomen (in het eerste experiment niet echt op gelet). | |
 In het begin lijkt een zweem van blauwkleuring waarneembaar. Waterstofvorming aan kathode duidelijk waarneembaar |
 Na ca. 45 min. Waterstofvorming aan kathode duidelijk waarneembaar |
 Na 3 uur elektrolyse. pH van de oplossing: 8 -9. |
 Na bezinken |
|
Ingedampte preparaten (objectief 4x) |
|
 Licht - voor bezinken |
 Licht - na bezinken |
 Donkerveld - voor bezinken Zoutkristallen Koper is niet zo duidelijk waarneembaar |
 Gepolariseerd - na bezinken Zoutkristallen |
|
Na het experiment kan men wederom zien dat de
anode is aangetast (verruwd) terwijl de kathode glanzend is. Op onderstaande
foto is te zien dat de “nanocoating” van zink verdwenen is en in oplossing
is gegaan volgens: Zn <=> Zn2+ + 2e |
|
 |
|
| Weegcijfers: | |
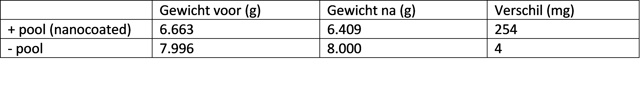 |
|
| De oplossing werd wederom afgefiltreerd waarbij na afschrapen 190 mg koperachtig materiaal werd teruggewonnen (Recovery: 190/254 = 75%). Wederom bleef een deel van het materiaal achter in het papier. Zoals men in Figuur 109 kan zien was in het filter was blauwkleuring waarneembaar hetgeen impliceert dat er koperionen gevormd zijn (koperchloride, CuCl2)). |
 |
|
Op basis van deze observaties kunnen we
concluderen dat het tweede experiment geen wezenlijk andere resultaten heeft
opgeleverd dan in het eerste experiment. Het laagje zink op de kathode lijkt
nauwelijks invloed uit te oefenen.
Een kritiekpunt op dit experiment zou kunnen zijn dat de elektrodes verkeerd gepolariseerd zijn. De foto’s die op facebook te vinden zijn suggereren dat de “genanocoate” koperelektrode verbonden met de kathode (- pool) en de koperelektrode met de anode (+ pool) [3]. |
|
| Experiment 22012023: "genanocaote" kathode | |
|
|
| In dit derde experiment is de “genanocoate” koperelektrode verbonden met de kathode (- pool) en de koperelektrode met de anode (+ pool). Na affiltreren is er geen blauwkleuring waargenomen in het filterpapier. Om meer inzicht te verkrijgen in de hoeveelheid koper die op het filter achterblijft is het filter voor en na affiltreren (en drogen) gewogen. | |
| Meetresultaten: | |
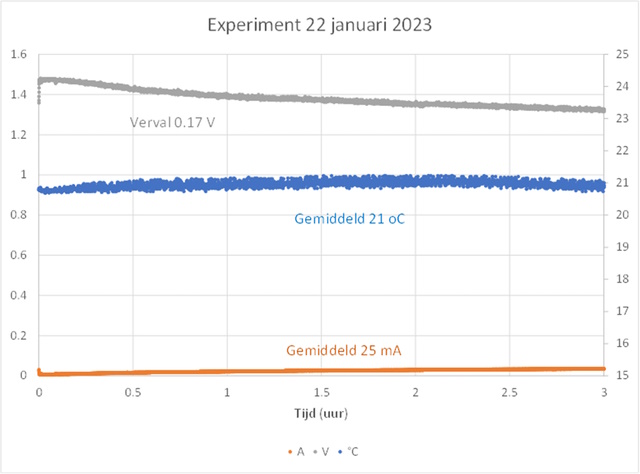 |
|
| Visuele observaties | |
| Zoals in onderstaande figuren te zien is zijn de resultaten niet wezenlijk anders dan in de eerdere experiment. De pH van de oplossing na elektrolyse was ca. 8-9. | |
 In het begin lijkt inderdaad een zweem van blauwkleuring waarneembaar. Waterstofvorming aan kathode duidelijk waarneembaar. |
 Na ca. 45 min. Waterstofvorming aan kathode duidelijk waarneembaar |
 Na 3 uur elektrolyse. |
 Na bezinken |
| Ook nu is de anode zwaar aangetast en de kathode glinstert. | |
|
|
|
| Ingedampte preparaten (objectief 4x | |
 |
 |
| Licht - voor bezinken | Licht - na bezinken |
 |
 |
|
Donkerveld - voor bezinken Zoutkristallen Koper is waarneembaar |
Donkerveld - na bezinken Zoutkristallen |
| Weegcijfers | |
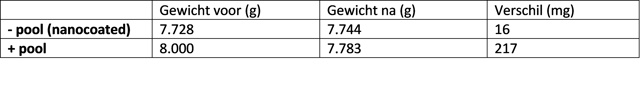 |
|
|
Geen blauwkeuring waarneembaar op filter.
Na affiltreren en drogen winnen we 171 mg koper terug door afschrapen van het filter (Recovery 79%). Het filter voor en na wegen geeft een opbrengst van 195 mg (Recovery 90%). Dit geeft aan dat ca 20 mg koper achterblijft op het filter. |
 |
| Vierde experiment | |
|
Op Facebook werd ook vermeld dat men andere typen cellen is gaan gebruiken
door o.a. elektrode combinaties te variëren zoal Koper/Zink maar ook door
Koolstof elektrodes te gebruiken[3]. In onderstaande Figuur demonstreren we
dat koper/zinkelektrodes die in een zoutoplossing geplaatst zijn geheel
volgens de theorie een batterij maken. |
|
 Koper/Zink elektrodes in een zoutoplossing geplaatst laten een spanningsverschil zien |
|
Discussie:
|
Het moge overvloedig duidelijk zijn dat de systemen die we bestudeerd hebben
vanuit een elektrochemisch perspectief uitstekend verklaarbaar zijn zonder
een beroep te hoeven doen op allerlei buitenissige verklaringen (Ockham’s
scheermes). Opgemerkt dient te worden dat alhoewel de analyse zeer
gedetailleerd lijkt men in principe nog dieper in het systeem kan duiken
(chemisch, fysisch, thermodynamisch). In dit onderzoekje hebben we ons
geconcentreerd op de verschillende configuraties die men kan maken met
koper/koper elektrodes met en zonder zink coating en kunnen op basis van de
waarnemingen concluderen dat er geen wezenlijk verschil is tussen deze
cellen. Op facebook zien we dat “keytohealth” ook andere elektrochemische
cellen (Zink/Koper en Koolstof/Koolstof elektrodes) in gebruik heeft genomen
die we niet verder bestudeerd hebben aangezien de oorspronkelijke vraag die
men zich stelde was of het mogelijk was om toxische concentraties koper op
te bouwen door het “plasma” te drinken. Een effect dat ook niet onderzocht
is, is het gebruik van andere oplossingen dan zoutoplossingen. De facebook
pagina’s lezende en sommige foto’s bekijkende (Figuur 1) lijkt het erop dat
de “gelovigen” sappen en andere vloeistoffen in de cel stoppen. Zeker als
men vruchtensappen gebruikt kunnen die de elektrochemie van de cel
beïnvloeden aangezien dit vaak zure oplossingen zijn. Als dat inderdaad zo
is dan gebruikt men meer viskeuze vloeistoffen, die het neerslaan van koper
kunnen bemoeilijken. Als koper metaal in de maag komt zal het oplossen in
het maagzuur (pH=1, bevat zoutzuur) volgens:
Cu (s) + 2HCl (aq) → CuCl2 (s) + H2 (g) De echte vraag blijft of we kunnen afschatten hoeveel koper opgenomen
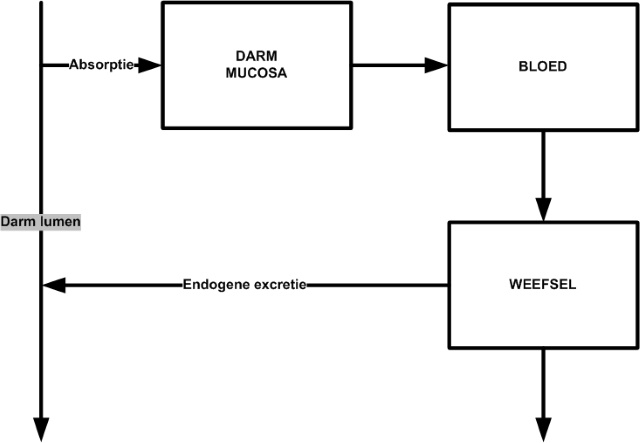
wordt in het lichaam. Koper wordt voornamelijk geabsorbeerd in de dunne
darm, een deel wordt ook in de maag opgenomen een schematische weergave is
weergegeven in onderstaande Figuur [15]. |
 |
|
De referentiewaarden voor koper in bloed zijn voor volwassenen 11-23 μmol/l, en in urine 0.15-0.95 μmol/l [16]. Voor een veilige inname van koper is door de Europese Voedselveiligheid Autoriteit (EFSA 2006) een bovengrens van 5 milligram per dag voor volwassenen vastgesteld [17]. Als men plasma drinkt dan zal het koper dat daarin opgelost zit via het maagdarmstelsel in het bloed komen. De hoeveelheid bloed in het menselijk lichaam is 7% van het lichaamsgewicht, en dit bestaat weer voor ongeveer de helft uit water. Gemiddeld heeft een volwassen vrouw 4.5 liter bloed en een volwassen man 5.6 liter bloed in het lichaam [18]. De basis van de evaluatie is het gewichtsverlies aan de anode. Aangezien alleen het plasma gedronken wordt verminderen we dat met de hoeveelheid teruggewonnen materiaal door filtratie en de hoeveelheid koper die op het filter achterblijft zoals we het bepaald hebben in het laatste experiment (No. 3, 20 mg). Om een meer conservatieve benadering te hanteren berekenen we de koperconcentratie toename voor een volwassen man (Molmassa koper 63.55 g/mol). De resultaten zijn samengevat in onderstaande Tabel.
|
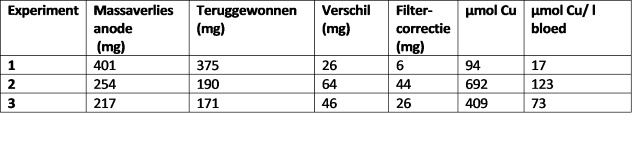 |
|
De resultaten lijken eenduidig, de hoeveelheid koper die opgenomen wordt
overstijgt de maximale bovengrens van 5 milligram per dag voor volwassenen
vastgesteld, ook omdat koper opgenomen zal worden uit andere
voedingsmiddelen. De verwachtte piekconcentraties in het bloed zullen ook de
normaalwaardes ruim overschrijden.
Een paar kanttekeningen zijn hier op zijn
plaats. De hoeveelheid koper die van de anode afgescheiden wordt is afhankelijk van een aantal factoren die we niet specifiek constant gehouden hebben in dit onderzoekje.
Stroomsterkte en batterijspanning zullen min of
meer identiek zijn voor de verschillende experimenten terwijl tijdsduur
(concentratie) en elektrodeoppervlak variabelen zijn die men iets moeilijker
kan vergelijken.
Het elektrode oppervlak (in Experiment 2 en 3 hebben we een
dikkere koperdraad gebruikt) is een variabele die niet constant is gehouden
gedurende de experimenten. Hoe groter het koperoppervlak des te meer koper
er in oplossing kan gaan en op de foto’s in Facebook afgaande zijn de
elektrodes daar wat groter (meer windingen, langer) hetgeen betekent dat
meer koper in oplossing is gegaan.
Een tweede kanttekening is dat men er in
de berekening van uitgaat dat al het koper onmiddellijk in het bloed wordt
opgenomen. Dat is onrealistisch, opname zal wat tijd nodig hebben hetgeen
betekent dat de koperpiek concentratie in het bloed lager zal liggen en wat
uitgesmeerd in de tijd zal worden. Hierbij kan dan wel weer de opmerking
gemaakt worden dat filtratie een beter middel is om vaste deeltjes te
scheiden van een vloeistof dan bezinken en overschenken. Bij bezinken en
overschenken is de kans groter dat meer koper in de oplossing achterblijft.
De tijdsduur is een variabele die constant gehouden is gedurende de
experimenten maar het is niet helemaal duidelijk hoe lang de “keytohealth”
gelovigen zelf de elektrolyse uitvoeren, des te langer des te meer koper in
oplossing gaat. De foto's op Facebook suggereren dat men wel wat langer dan 3 uur elektrolyseert. Het volume van de zoutoplossing waarin de elektrolyse wordt
uitgevoerd zal mede de concentratie bepalen. Bij de experimenten is ca.
200-250 ml zoutoplossing gebruikt terwijl de foto's op Facebook suggereren dat
“keytohealth” iets grotere volumes hanteert hetgeen mogelijk tot iets lagere
concentraties kan leiden. Het gebruik van grotere elektrodes en een langere
elektrolyseduur zou zulk een effect echter snel teniet doen. Ondanks enkele mitsen en maren geven de resultaten aan dat het drinken van het “plasma” tot een overmatige inname van koper kan leiden hetgeen nadelig kan zijn voor de gezondheid. De meest voorkomende acute symptomen zijn buikklachten, misselijkheid, braken, buikpijn en diarree. Deze gevolgen ontstaan korte tijd na blootstelling en houden meestal niet lang aan. Acute buikklachten als gevolg van een enkele dosis koper komen voor bij kopergehaltes van 30 mg/l vloeistof en hoger. Bij inname van een zeer hoge enkele dosis koper, kan onder andere lever- en nierschade ontstaan [19, 20,21 22]. |
Conclusies:
| Deze nogal uitgebreide analyse
van de elektrochemische cel is gemaakt om te laten zien dat het systeem
volledig elektrochemisch verklaarbaar is zonder een beroep te hoeven
doen op plasmaverschijnselen of alchemische transmutaties.
Op basis van de gevonden meetresultaten en de daaropvolgende analyse concluderen we dat het drinken van elektrochemisch bereid “plasma” een verhoogd gezondheidsrisico inhoudt door een verhoogd risico op een inname van teveel koper. |
Opmerkingen:
|
Een iets beknoptere versie van dit
artikel is gepubliceerd op KloptDatWel: https://kloptdatwel.nl/2023/02/01/kopervergiftiging-ligt-op-de-loer-met-de-plasma-en-gans-therapie-van-silvia-hoevenaar/ |
Literatuur:
|
|
|
04/03/2023