Smeltpunt (stolpunt) bepalen van een waxine lichtje (CoachLab)


|
Smeltpunt (stolpunt) bepalen van een waxine lichtje (CoachLab) |

|

|
Datum: December 2023
Inleiding:
| Dit is een experiment dat ik al eens in 2001 handmatig heb uitgevoerd. Ik zag het experiment vermeld staan in de CMA projecten lijst en dacht laat ik het weer eens proberen en nu ook eens een blik werpen op de reproduceerbaarheid van de meting. |
Materiaal:
|
|
Uitvoering:
|
  |
 |
|
| Screenshot CMA project "Afkoelen van stearinezuur" | |
 |
|
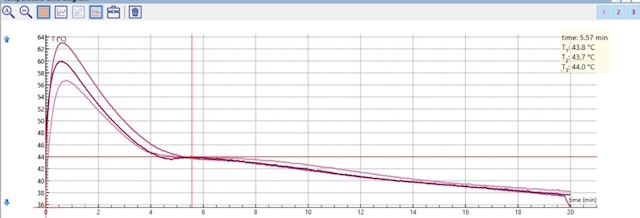
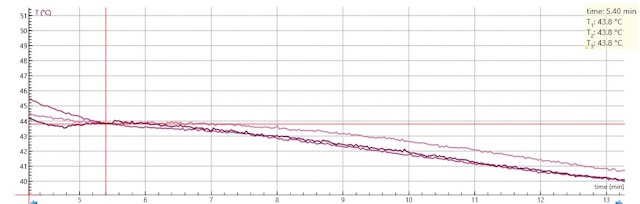
Resultaten:
|
|
 |
|
 |
|
| Het smelt/stolpunt dat we dan uitlezen is: 43.8 °C | |
Discussie:
|
Volgens de kinetische molecuul theorie is materie opgebouwd uit moleculen
die voortdurend in beweging zijn, waarbij de mate van beweging afhankelijk
is van de temperatuur. Moleculen oefenen krachten op elkaar uit waarbij de
sterkte van deze krachten afhankelijk zijn van de temperatuur en de fase
(vast, vloeistof, gas). Als materie verwarmd wordt (we voegen energie toe)
gaat de temperatuur van het betreffende object ook omhoog hetgeen kan leiden
tot een toestandsverandering. De inwendige energie neemt toe (als de
temperatuur omhoog gaat, neemt de kinetische energie toe omdat de moleculen
sneller gaan bewegen, zowel in termen van vibratie als in termen van rotatie
- Ekin=½mv2). Bij de overgang van vast naar vloeistof worden relatief grote
hoeveelheden potentiële energie opgeslagen zonder verandering van de
gemiddelde kinetische energie of de temperatuur.
Gedurende smelten of kristalliseren verandert de temperatuur dus niet (dit kunnen we ook waarnemen in het experiment). Om een mol was te laten smelten is een constante hoeveelheid energie nodig, deze hoeveelheid energie noemen we de smeltwarmte. De molaire smeltwarmte is dus de hoeveelheid energie die nodig is om een mol stof te laten smelten bij het smeltpunt. Deze energie wordt gebruikt om de aantrekkingskracht tussen de was moleculen te verbreken zodat de driedimensionale structuur van de was verbroken wordt. |
||||
| Een kaars bestaat uit een pit van katoen met daaromheen stearine, paraffine of een mengsel van beide (composietkaarsen), maar ook wel bijenwas of sojawas. In dit experiment hebben we een waxinelichtje gebruikt. Waxine is meestal een mengsel van paraffine en stearine. Stearine (een mengsel van stearinezuur en palmitinezuur,) wordt gebruikt om het smeltpunt te verhogen. In het algemeen zullen de paraffines en vetzuren die in het kaarsvet gebruikt worden tussen de 45 en 62 °C smelten. | ||||
| In de literatuur (Binas/Merck Index/Wikipedia) vinden we de volgende smeltpunten: | ||||
|
||||
| In 2001 heb ik ook een waxine lichtje onderzocht maar het smelt/stolpunt dat ik indertijd vond lag beduidend hoger nl 55.8 °C hetgeen suggereert dat er meer stearine in deze waxine gebruikt werd. Dat doet mij vermoeden dat het waxinelichtje dat ik onderzocht heb niet een echt waxinelichtje was maar een geurkaars. Ik heb me voor de selectie van het waxinelichtje laten leiden door de witte kleur maar dat is dus niet eenduidig. Geurkaarsen zijn vaak gebaseerd op sojawas waarbij de geuren gevormd worden door het toevoegen van etherische oliën. Het toevoegen van de etherische oliën heeft dan mogelijk geleid tot een verlaging van het smeltpunt dat iets buiten het gebruikelijke traject ligt. |
Conclusie:
|
Opmerkingen:
|
Literatuur:
Relevante websites: |
|
|
|
De thermodynamische benadering.
Voor een enkelvoudige stof geldt dat, indien bij een bepaalde temperatuur en druk twee fases met elkaar in evenwicht zijn, de chemische potentiaal gelijk is. In het geval van een vaste stof in evenwicht met een vloeistof geldt dus:
Bij een verandering van temperatuur en druk geldt dan dat de chemische potentiaal nieuwe waardes heeft gekregen, m.a.w.:
Aangezien
Dit betekent dat: Kijken we nu naar de vrije enthalpie dan geldt de toestandsfunctie: G = H – TS Hetgeen de volgende differentiaal geeft:
In combinatie met de andere toestandsvergelijking: H = U + pV Hetgeen de volgende differentiaal geeft:
Gecombineerd krijgen we dan:
Volgens de eerste hoofdwet (U=A+Q) geldt bij een reversibel proces waarbij alleen arbeid wordt verricht door vergroting van het volume:
Ingevuld geeft dat:
M.a.w. voor de hierboven besproken chemische potentiaal geldt:
geeft:
In de evenwichtstoestand is DG=0 en geldt dat DH=TDS dan kunnen we schrijven dat:
D H is in dit geval de verandering van de enthalpie bij de fase overgang (hier van S --> L, en is dus de smeltwarmte). DV is de volumeverandering die bij de faseovergang optreedt. Bij een overgang van een vaste naar een vloeibare fase neemt de wanorde toe, we gaan van een "rigide" geordende structuur naar een minder geordende, meer chaotische structuur, de entropie neemt dus toe. De smeltenthalpie is positief en de volumeverandering is meestal positief en klein met als gevolg dat dp/dT steil is en meestal positief. We kunnen nu de formule voor de faseovergang afleiden door dp/dT te integreren waarbij we aannemen dat DH en DV dermate weinig veranderen dat we ze als constant kunnen beschouwen. Dus, bij een smelttemperatuur T* met een bijbehorende druk p* krijgen we:
Hetgeen betekent dat we de S-L overgang ongeveer kunnen beschrijven met:
Deze vergelijking werd oorspronkelijk verkregen
door Lord Kelvin.
Dus,
Dit is de vergelijking van een rechte lijn als we p tegen T uitzetten. |
13/12/2023