Diffusie van zout door een membraan (CoachLab)


|
Diffusie van zout door een membraan (CoachLab) |

|

|
Datum: Juni 2024
Inleiding:
| Ik ben al langer in membranen geÔnteresseerd, tijd om eens wat meer te experimenteren. |
Materiaal:
|
|
 |
|
 |
|
Uitvoering:
|
Screenshot van de Coachlab software
tijdens het meten |
Resultaten:
|
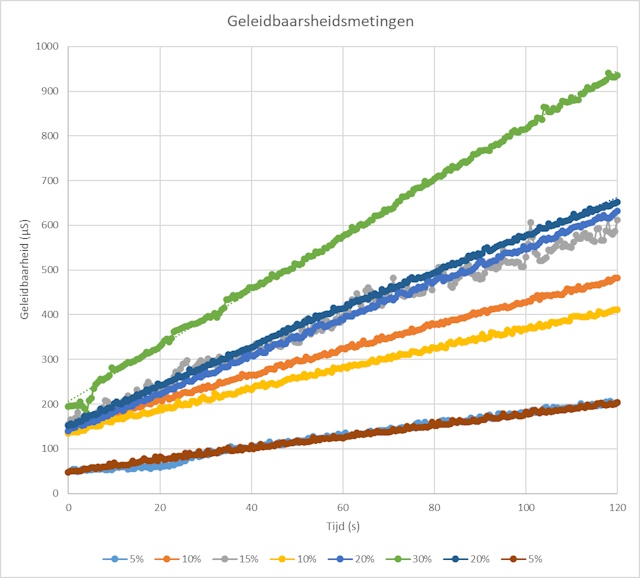
Alle metingen zij weergegeven in onderstaande grafiek die binnen Coachlab weergegeven wordt. |
|
|
|
|
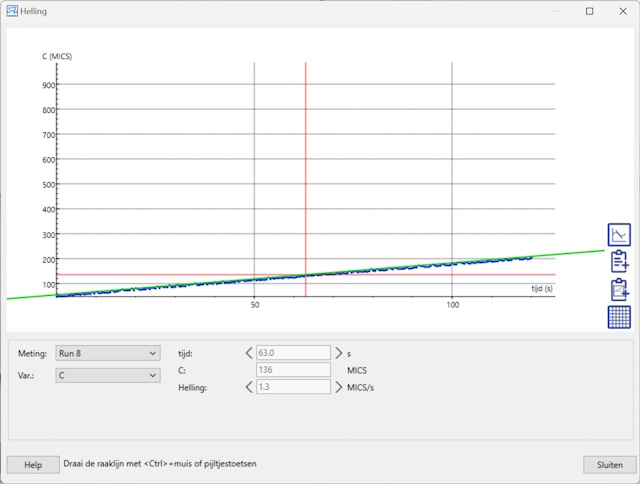
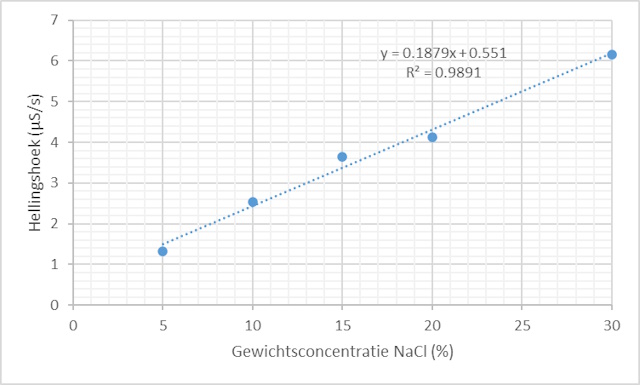
| De grafieken laten zien dat de hellingshoek toeneemt als de concentratie toeneemt. Om de hellingshoek te bepalen zijn er twee mogelijkheden. De eerste mogelijkheid is om deze te bepalen binnen CoachLab zelf door de te analyseren grafiek te selecteren, op de rechtermuisknop te klikken en vervolgens Analyse/Verwerking en Helling te selecteren. Door vervolgens de groen lijn over de meetlijn te leggen m.b.v. de muis kan men rechtstreeks de hellingshoek uitlezen. | |
 |
|
| De tweede mogelijkheid is om de grefieken te exporteren als CSV file die men vervolgens in Excel laadt voor verdere analyse. Men kan o.a. de resultaten iets kleuriger weergeven en ook hier de hellingshoek bepalen. | |
 |
|
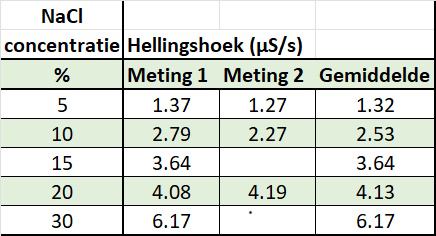
| De gesorteerde resultaten in tabelvorm en in grafiekvorm | |
 |
|
 |
|
Discussie:
|
Zoals in Achtergrondinformatie meer formeel beschreven wordt is diffusie de verplaatsing van een stof van een plaats met een hoge concentraties naar een plaats met een lage concentratie van die stof. In gassen en vloeistoffen in evenwicht bewegen zich deeltjes (moleculen) volledig willekeurig, de zogenaamde Brownse beweging. Diffusie komt tot stand doordat in een systeem dat niet in evenwicht is, er een concentratie gradiŽnt aanwezig is, waardoor zich gemiddeld genomen meer moleculen richting de lagere concentratie bewegen, totdat het systeem weer in evenwicht is (concentratie gelijk is).
Een manier om een geconcentreerde oplossing in een minder geconcentreerde oplossing te plaatsen zonder dat deze onmiddellijk gaan mengen is door gebruik te maken van een membraan. Het membraan fungeert als scheidingswand tussen twee fases en als selectiemiddel voor het al dan niet doorlaten van deeltjes. Het dialysemembraan, een semi-permeabel membraan, zoals we het in dit experiment gebruikt hebben filtert als het ware op grootte. Water, Natrium en Chloride ionen passen door de poriŽn in het membraan. Door diffusie zullen de natrium en chloride ionen zich door het membraan verplaatsen van de hoge concentratie binnen het membraanzakje naar de lage concentratie binnen het bekerglas. Door nu de concentratie van het zout in het dialysemembraan te variŽren kunnen we bepalen hoe de diffusiesnelheid beÔnvloed wordt door de concentratie.
In het experiment bepalen we de snelheid van
het diffusieproces door het meten van de ionen concentratie in de oplossing
gedurende een bepaalde tijdsperiode. Ionen zijn geladen deeltjes die ervoor
zorgen dat een waterige oplossing elektriciteit kan geleiden en ontstaan in
dit experiment door het oplossen van Natriumchloride in water volgens:
NaCl(s) + H2O
--> Na+(aq) + Cl-(aq) + H2O Dit geleidingsvermogen kunnen we meten met een geleidbaarheidssensor (Zie Achtergrondinformatie). Als de geleidbaarheid van de oplossing toeneemt geeft dit aan dat de ionconcentratie toeneemt hetgeen weergegeven wordt door de stijgende lijn in een meting. De meting laat een rechte lijn zien hetgeen aangeeft dat de snelheid waarmee de ionen door het membraan bewegen constant is. De toename in hellingshoek laat dan weer zien dat deze snelheid toeneemt als de concentratie toeneemt. Aangezien we steeds hetzelfde membraan gebruiken en daar ook steeds dezelfde hoeveelheid zoutoplossing instoppen is het oppervlak dat blootgesteld wordt aan het water constant. Het gebruik van een roerboon zorgt ervoor dat ionen die door het membraan migreren gelijk door de oplossing verspreid worden. Hierdoor reduceren we extra variatiefactoren in de meting waardoor we een redelijke correlatiecoŽfficiŽnt krijgen. De grafiek gaat niet door nul hetgeen we kunnen verklaren door de 15 s die we wachten voordat we de meting opstarten, ionen zijn dan al door het membraan gemigreerd. |
Opmerkingen:
|
| Literatuur: |
Relevante websites: Minder relevante websites: |
|
Achtergrondinformatie: |
|
Massatransport
Componenten die zich binnen een fase bewegen doen dit onder invloed van een concentratieverschil. Er ontstaat dus een stroom als gevolg van een oorzaak, de ďdrijvende krachtĒ. Voor een korte lengte Dx kunnen we dan een debietvergelijking opstellen:
HerdefiniŽren we deze in termen van eendimensionaal stationair transport dan krijgen we de wet van Fick waarin we de fluxvergelijking opstellen:
Volgens deze wet is de diffusiesnelheid rechtevenredig met het concentratieverval. Hierin is D de diffusiecoŽfficiŽnt in m2s-1. Het is een temperatuurafhankelijke stofeigenschap en is een maat voor de snelheid waarmee in het betreffende medium stof diffundeert. Voor de diffusiecoŽfficiŽnten in vloeistoffen vindt men bij kamertemperatuur waarden in de orde van 10-8 a 10-9 m2s-1; voor andere temperaturen kan men een bij een temperatuur gegeven diffusiecoŽfficiŽnt omrekenen met de relatie van Einstein-Nernst-Eyring: Dh/T (h is de viscositeit van het oplosmiddel). Beschouwen we nu een materiaalbalans over een schijfje met dikte dx en met als oppervlak de eenheid van oppervlak (het volume van het schijfje is dus dx).
De balans luidt: in = uit + accumulatie
Hetgeen de tweede wet van Fick is die informatie geeft over de concentratieverandering in de tijd. |
| Osmose |
| Osmose kan men beschouwen als een speciaal geval van diffusie nl de diffusie van water van een oplossing met een lagere concentratie naar een oplossing met een hogere concentratie van een bepaalde component. Dat kan echter alleen maar plaatsvinden als de oplossingen gescheiden zijn door een membraan waar water wel doorheen kan maar de component dus niet. Men spreekt dan van een halfdoorlatend of semipermeabel membraan. De beweging van de watermoleculen noemt men dan geen diffusie meer maar osmose. |
| Conductometrie |
|
Conductometrie betekend
geleidbaarheidsmeting. Bij elektrische geleidbaarheid meet men de
elektronische weerstand tussen twee elektroden in bv. vloeistoffen.
Hoe kleiner de weerstand des te hoger het geleidend vermogen (=geleidbaarheid) en omgekeerd. Stoffen, zoals in water opgelost zout, verlagen de elektrische weerstand en verhogen daarmee de geleidbaarheid. Bijvoorbeeld keukenzout Indien water met keukenzout (NaCl) wordt vermengd, dan valt deze stof uitťťn in zijn bestanddelen (ionen) Na+ en CIĖ. Deze ionen zijn geladen deeltjes en daarmee verantwoordelijk voor de mate van geleidbaarheid van het water. De geleidbaarheid geeft dus informatie over de som van opgeloste, geladen bestanddelen. De geleidbaarheid is een maatstaf voor de ionenactiviteit in water of voor de aanwezigheid van gedissocieerde stoffen in een waterige oplossing. Oplossingen van de meeste anorganische zuren, basen en zouten zijn relatief goede geleiders. Organische bestanddelen, niet gedissocieerd in waterige oplossingen, zijn zwakke stroomgeleiders. Een grafiek om de conductormetrische meetresultaten om uit te zetten is het gebruikelijk om op de verticale as het geleidingsvermogen in Ohm-1 uit te zetten en op de horizontale as het aantal toegevoegd zuur/base in ml. Het (elektrische) geleidingsvermogen G van een oplossing wordt gedefinieerd als het omgekeerde van de weerstand van de oplossing en wordt uitgedrukt in siemens (S = Ohm-1) Het geleidingsvermogen en daarmee de geleidbaarheid is een grootheid die afhangt van:
De geleidbaarheid is sterk afhankelijk van de temperatuur van de oplossing. De toename van de geleidbaarheid met stijgende temperatuur bedraagt ongeveer 1,9 % / įC. De meetwaarde dient gecorrigeerd te worden zelfs bij geringe verschillen van de meettemperatuur en de referentietemperatuur (25įC). De geleidbaarheidsmeting kan gestoord worden door de aanwezigheid van onopgeloste stoffen (vetten, oliŽn, minerale stoffen, metaaldeeltjes, enz.). Eventuele luchtbellen tussen de elektroden kunnen de meting storen (verwarmen van het monster tot de meettemperatuur). Bij monsters waarvan de geleidbaarheid kleiner is dan 10 ĶS/cm wordt de meting gestoord door de invloed van de lucht (eventuele opname van CO2).
|
|
De geleidbaarheid van een oplossing kunnen we als volgt formuleren:
Waarin:
De specifieke geleidbaarheid van een oplossing hangt af van de samenstelling. De specifieke geleidbaarheid van een oplossing van een zuiver elektrolyt hangt af van de concentratie. Om de geleidbaarheid van oplossingen van verschillende elektrolyten te kunnen vergelijken moeten we de concentraties in een maat uitdrukken die vergelijking mogelijk maakt. Onder de equivalentgeleidbaarheid L verstaan we de specifieke geleidbaarheid van een (hypothetische) oplossing die 1 equivalent per cm3 bevat. Dus:
|
11/06/2024