Synthese van tinchloride en experimenteren met tinchloride


|
Synthese van tinchloride en experimenteren met tinchloride |

|

|
Datum: Juni - Oktober 2024
Inleiding:
| Ik wilde een elektrochemisch experiment doen met tinchloride (van Erp). Daar heb ik maar een kleine hoeveelheid van in mijn bezit dus ik probeerde het bij te maken. |
Materiaal:
|
|
Uitvoering:
| Reactie met zoutzuur/salpeterzuur | |
|
|
| Reactie met salpeterzuur | |
|
|
| Test reacties volgens van Erp | |
|
|
| Test reactie - vorming van CuCl | |
|
|
| Indampen en observeren | |
|
|
| Tin dendrieten maken | |
|
 |
| SnCl2 oplossing als referentie | |
|
|
Resultaten en discussie:
| Reactie met zoutzuur/salpeterzuur | |
|
Als men de soldeertin in het zoutzuur stopt
ziet men een lichte metaalverkleuring maar verder niet veel.
Op basis van de literatuur besloot ik daarom om een beetje verdund salpeterzuur toe te voegen. Dit zou het tin moeten oxideren. Visueel was daar echter in eerste instantie niets van te zien. Ik besloot daarom de oplossing af te gieten en in te dampen. Vervolgens heb ik de soldeertin in een verse zoutzuuroplossing gestopt waaraan een druppel gec. HNO3 aan was toegevoegd. Hier is na enige tijd duidelijk verwering van de soldeertin waarneembaar. |
 |
|
Uiteindelijk besloot ik om de op deze manier geproduceerde tinchloride in
een mikrochemische reactie te gebruiken als methode om te bevestigen dat ik
inderdaad tinchloride had gemaakt. Dit werkte inderdaad. Daarnaast heb ik met deze oplossing de testreacties uitgevoerd die in Van Erp beschreven staan. Ook heb ik wat vloeistof op een objectglas gebracht en laten indampen, hetgeen resulteert in kristalvorming. |
 |
| Reactie met salpeterzuur | |
|
Als men het salpeterzuur toevoegt aan de soldeertin ziet men bijna onmiddellijk een wit neerslag en de vorming van een bruinkleurig gas ontstaan. |

|
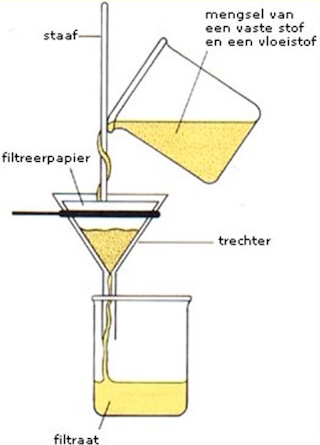 |
Na filtratie het materiaal in een droogkamer gestopt. |
|
De vraag is of laten drogen wel lukt. Het materiaal lijkt hygroscopisch te
zijn. Het materiaal is ook niet helemaal wit er zitten bruine vlekjes in.
Misschien gerelateerd aan de andere component in de soldeertin (Cu) of
misschien de harskern? Deze wordt niet vermeld maar wordt vaak aan de
kern toegevoegd. De hars zorgt ervoor dat de te solderen oppervlakken
ontdaan worden van oxiden, zodat het soldeer goed vloeit. Ik besloot daarom
de droogkamer op een verwarmingsplaat te zetten. Het materiaal droogde wat
meer op maar zag er nog steeds een beetje "vochtig" uit. Ik besloot het materiaal uit het filter te halen af te wegen (4.7 g) en over te brengen in een flesje. Aan dat flesje heb ik zoutzuur toegevoegd, goed geschud en laten staan. Het materiaal lost grotendeels op. Na bezinken blijven er fijne deeltjes in de oplossing rondzweven en op de bodem ligt nog onopgelost materiaal. |
 |
 |
|
 |
Gezien de oplosbaarheid van tinchloride in water (83.9 g/100 ml (0 °C))
suggereert dit dat we geen tinchloride maken op deze manier. Als we een druppel op een objectglas doen en indampen krijgen we geen mooie kristallen. Het materiaal dampt in laat meer een filmlaag met puntjes en belletjes achter zoals op onderstaande foto te zien is. |
 |
|
| In eerste instantie probeerde ik tinchloride te maken door het in zoutzuur op te lossen maar ik heb geen geconcentreerd zoutzuur en de reactie verloopt maar langzaam. Daarom bedacht ik me dat ik me ook zou kunnen redden met salpeterzuur, alleen reageerde dat wat anders dan ik verwachtte. De literatuur helpt bij het verklaren van de waargenomen reacties. | ||
|
Tin (Sn) reageert met geconcentreerd
salpeterzuur en produceert metatinzuur volgens de volgende bruto
reactie vergelijking: Sn(s) + 4HNO3(l) --> H2SnO3(aq) + 4NO2(g) +H2O(l) |
||
|
Het tin reageert eerst met salpeterzuur om het
nitraatzout te vormen, dat is echter zeer reactief en reageert met water
onder de vorming van tinoxide (SnO2). Meer specifiek wordt de gehydrateerde
vorm daarvan gevormd β-tinzuur (stannic acid, metatinzuur).
Pogingen om het gevormde witte materiaal, na drogen, weer op te lossen in zoutzuur werkten niet goed hetgeen mij eraan laat twijfelen dat ik met de "alleen salpeterzuur" methode wel tinchloride heb gemaakt. Ik vermoed dat het voornamelijk tinoxide is gebleven. |
||
| Reactie met zoutzuur/salpeterzuur | ||
|
Door het tin bloot te stellen aan salpeterzuur
in een zoutzuur oplossing katalyseren we de vorming van tinchloride (
verwering van het oppervlakte?). Eenzelfde effect kan ook bereikt
worden door wat platinafolie toe te voegen waardoor een galvanische cel
gevormd wordt. Dat heb ik echter niet in mijn bezit waardoor ik dit
niet kon uittesten. Indampen van de op deze manier geproduceerde vloeistof lijdt (soms) tot de vorming van karakteristieke kristallen. Jammer genoeg heb ik geen betrouwbare referentie kunnen vinden die laat zien dat dit inderdaad tinchloride kristallen zijn. |
||
|
|
||
|
Het blijft een probleem om tinkristallen te
maken via de verdampingsmethode. Te vaak heeft men te maken met een meer
gelatineuze laag waarin soms wat kristallen liggen. Ook als men tinchloride
zelf als grondstof gebruikt ontstaat de witte troebeling (waarschijnlijk
metatinzuur) waarbij affiltreren niet altijd helpt. De reden om me te verdiepen in het maken van tinchloride is een reactie die ik vond in het boek van Van Duyn. In van Duyn's boek vond ik een beschrijving van een mikrochemische reductie waarbij Cuprochloride (Cu1+) gevormd wordt hetgeen zich manifesteert als zeer karakteristiek tetraëder kristallen, volgens onderstaande reactie: |
||
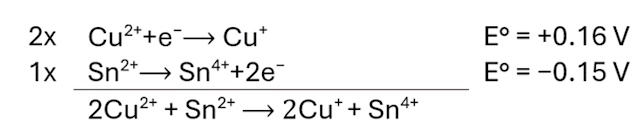 |
||
| Zoals men op onderstaande foto kan zien worden inderdaad tetraëder kristallen gevormd als men de gemaakte oplossing in aanraking brengt met een kopersulfaat oplossing (vergroting 100x). (NB. zwart betekent volledige reflectie) | ||
|
|
||
| Test reacties volgens van Erp | ||
|
 |
|
 |
 |
|
| Na toevoegen van zuur | En vervolgens weer loog (er vormt zich weer een wit neerslag dat vervolgens oplost) | |
| Elektrochemie - Tindendriet vorming | ||
|
Optredende reactie: Sn2+ (oplossing) + 2e– –> Sn (vast) Deze demonstratie maakt gebruik van een elektrische stroom om een redoxreactie te veroorzaken in een oplossing van tin (II) chloride. Tin(II)ionen worden geoxideerd tot een onoplosbaar neerslag van tin (IV) chloride-ionen bij de anode en gereduceerd tot metaalachtig tin bij de kathode. Oxidatie halfreductie (anode) Sn2+ (aq) → Sn4+ (aq) + 2e– Sn4+ (aq) + 4Cl– (aq) → SnCl4 (s) Reductie halve reactie (kathode) Sn2+ (aq) + 2e– → Sn(s) Algemene reactie (disproportionering) 2Sn2+ (aq) + 4Cl– (aq) → SnCl4 (s) + Sn (s) De algehele reactie wordt een disproportioneringsreactie genoemd – een chemische reactie waarbij één reagens zowel als oxiderend werkt en reductiemiddel. Als resultaat wordt het reagens (Sn2+ -ionen) omgezet in zowel een meer geoxideerd als een meer gereduceerd product. De tin-dendriet groeit in de richting naar de positieve pool zodat de elektrische stroom door de oplossing stroomt. Hier zet tin af op de kathode en groeit uit tot dendrieten. |
||
|
De vorming van tin dendrieten is vastgelegd in onderstaande filmpjes. De dendriet vorming lukt alleen met heldere, licht aangezuurde, oplossingen. Als men troebeling in de oplossing heeft moet men deze eerst affiltreren. Onderstaande filmpjes over de dendrietvorming zijn gemaakt door een 0.5 M SnCl2 oplossing te maken en die (soms) meerdere malen af te filtreren tot deze helder was. Pogingen om dendrieten te maken het via zoutzuur gemaakte tinchloride liepen op niets uit. Ook niet na de oplossing enigszins geneutraliseerd te hebben met ammonia ervoor zorgende dat de oplossing helder blijft. |
||
|
YouTube link: Tin dendriet vorming |
||
|
Onderstaande filmpje is met een USB microscoop gemaakt en wordt 16x
versneld weergegeven. |
||
|
YouTube link: Tin dendriet vorming |
||
|
Al met al durf ik ondertussen wel te beweren dat ik via de "soldeertin/zoutzuur/druppels salpeterzuur" methode inderdaad een tinchloride oplossing produceer maar dat het op deze manier gep[roduceerde tinchloride niet geschikt is voor het maken van tindendrieten. |
||
Conclusie:
|
Opmerkingen:
|
Literatuur:
|
Relevante websites:
Minder relevante websites:
|
Achtergrondinformatie: |
|
Tin is een zilverwit metaal met een
smeltpunt van 232 °C.
Tin is een betrekkelijk 'edel' metaal. Het wordt door zuurstof uit de lucht slechts oppervlakkig aangetast. Er ontstaat een beschermende laag tinoxide, zodat verdere inwerking wordt verhinderd. |
13/10/2024