Microbiologische elektrochemische cel


|
Microbiologische elektrochemische cel |

|

|
Datum: December 2024
Inleiding:
| Microbiologische activiteit als accu, interessant genoeg om zelf eens te proberen. |
Principe:
| M.b.v. gist en suikers bouwen we een microbiologische batterij |
Materiaal:
|
|
|
|
 |
Uitvoering:
| Bekerglas test | |
|
|
|
|
|
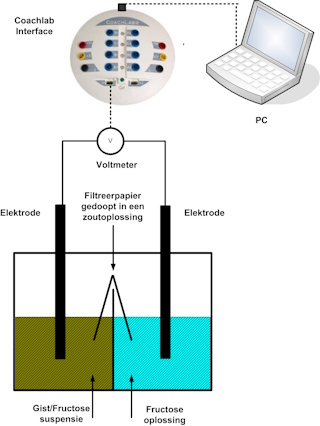
Microbiologische brandstofcel |
|
|
 |
 |
 |
|
Schroeven als elektrodes |
Spijkers als elektrodes |
Resultaat:
|
Bekerglas test |
|
 |
|
| Tijd: 14:20 | |
 |
|
| Tijd: 14:51
Ontkleuring duidelijk waarneembaar in de verwarmde oplossing (rechter) |
 |
 |
|
| Tijd: 20:39 | |
 |
|
| Dag later Tijd: 17:24 |
|
| Coachlab meting | |
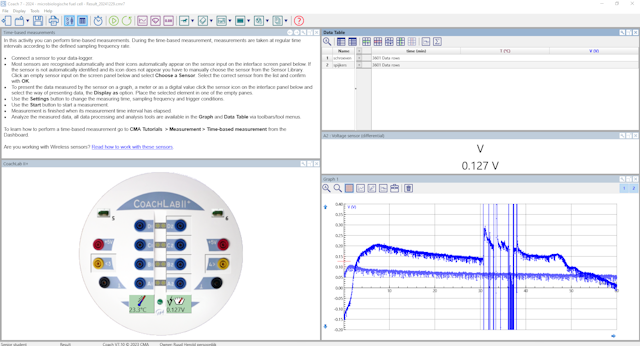
| In onderstaande screenshot van het CoachLab scherm zijn twee metingen weergegeven. In een geval (onderste lijn) zijn schroeven als elektrodes gebruikt, in het andere geval (bovenste lijn) spijkers. | |
 |
|
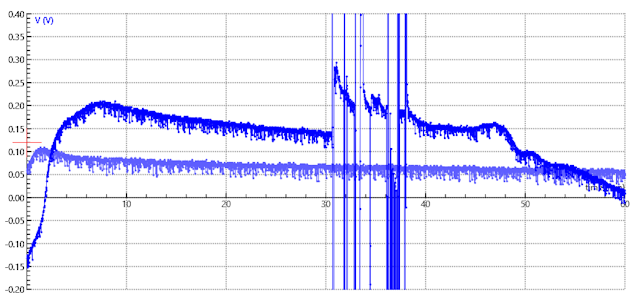
| De meetgrafiek wordt vergroot weergegeven. | |
 |
|
| De spikes in de bovenste grafiek zijn een poging om met een multimeter de stroomsterkte te meten. De digitale multimeter gaf achter geen waarde aan en ik begrijp niet goed waarom. | |
Discussie:
| Bekerglas test |
| De test laat zien dat methyleenblauw ontkleurd wordt hetgeen aangeeft dat elektronen vrijkomen door metabolische activiteiten van het gist. Methyleenblauw is een redox indicator die door opname van elektronen van kleur veranderd, van blauw naar de kleurloze leuco vorm. |
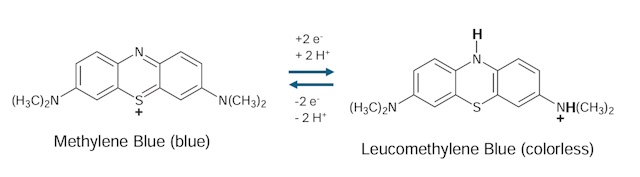 |
| Coachlab meting |
|
In de coachlab meting kunnen we duidelijk
een spanningsverschil meten tussen beide elektrode, wederom een
aanwijzing dat er elektronen getransporteerd worden. De experimenten laten een groter potentiaalverschil zien als spijkers als elektroden gebruikt worden dan als de schroeven gebruikt worden. De schroeven zijn duidelijk grote dan de spijkers dus een groter oppervlak kan dit verschil niet verklaren. Een meer aannemelijke verklaring is dat de schroeven van een ander materiaal zijn. Terwijl de spijkers na het experiment snel gaan roesten (ijzer) is dat niet het geval voor de schroeven (staal of evt. verchroomd), een observatie die deze aanname ondersteund. De schroeven zijn dus duidelijk minder geschikt als elektrodemateriaal. Een andere observatie die we kunnen
maken is dat het grootste spanningsverschil dat we kunnen meten
ca. 300 mV is, terwijl de literatuur aangeeft dat we een redelijk
constant spanningsverschil van ca. 400 mV kunnen verwachten (Grandrath
et al). Dat verschil is mogelijk verklaarbaar door het gebruik van
spijkers i.p.v. plaatjes, die een groter oppervlak hebben. |
| Een microbiŽle brandstofcel zoals we die hier gebouwd hebben is in feite een soort accu/batterij die wordt opgeladen door de activiteit van micro-organismen. Het potentiaalverschil dat we waarnemen wordt veroorzaakt door de metabolische activiteit van het gist in het anode deel van de cel. In dit experiment, bij een temperatuur van ca. 20 įC, meten we een potentiaalverschil van maximaal ca. 300 mV. Naarmate de concentratie van het substraat en de pH in het anode deel verder afnemen, hetgeen een maat is voor de afname van de metabolische activiteit van de gistcellen, daalt het gemeten Voltage. |
| De vereenvoudigde
reactievergelijkingen voor de cel zijn: Anode: C6H12O6 + 6H2O -- gist --> 6CO2 + 24H+ + 24e- Kathode: O2 + 24H+ --> 12H2O Overall: C6H12O6 + O2 -- gist --> 6CO2 + 6H2O |
| Zuurstof is de elektronen acceptor in dit systeem. Als we sucrose als substraat zouden gebruiken wordt dit eerst gesplitst in glucose en fructose die vervolgens geoxideerd worden. Dan zal het iets langer duren totdat een voltage gemeten wordt. |
Conclusies:
|
|
|
|
|
Relevante websites:
Minder relevante websites: |
Opmerkingen:
|
Achtergrondinformatie:
Om elektrodeprocessen te kunnen bestuderen
gebruikt men een
elektrochemische cel. Deze bestaat in zijn eenvoudigste vorm uit twee
geleiders (elektroden) geplaatst in een vat gevuld met
elektrolytoplossing. Bij stroomdoorgang door een dergelijke cel moeten
aan de elektroden reacties plaatsvinden waarbij de lading in de vorm van
elektronen of ionen het grensvlak elektrode/oplossing passeert. De
elektrode waaraan oxidatie plaatsvindt wordt anode genoemd, de elektrode
waaraan reductie plaatsvindt heet kathode. Voor de anodische
reactie kunnen we schrijven (e = elektron):
Voor de kathodische reactie:
De bruto celreactie wordt dan:
Stroomdoorgang kan alleen plaatsvinden indien er een gesloten circuit bestaat. We moeten beide elektroden daarom uitwendig met elkaar verbinden. Levert een elektrochemische cel bij het tot stand komen van dit elektrisch contact spontaan stroom, dan spreken we van een galvanische cel. In dit geval wordt de chemische energie omgezet in elektrische energie (accu!). Indien daarentegen een uitwendige spanningsbron moet worden aangesloten om stroom door de cel te doen vloeien, dan spreken we van een elektrolytische cel. Hierbij wordt elektrische energie omgezet in chemische energie (accu opladen). De celreactie verschilt alleen daarin van een normale redoxreactie in oplossing, dat de elektronen nu niet direct van het ene deeltje op het nadere worden overgedragen maar via een uitwendig circuit. |
29/12/2024