

| Kosmos brandstofcel auto |  |
 |
Datum: augustus 2006
Principe:
Een waterstof auto bouwen en er enkele experimenten mee uitvoeren.
Materiaal:
|
|
|
| Deze Kosmos (www.kosmos.de) brandstofcel model auto kan besteld worden via de site van Conrad (www.conrad.nl) en bevat alle onderdelen de men nodig heeft om de brandstofcel auto op te bouwen en om er experimenten mee uit te voeren. |
|
| Coachlab II met Ultrasone Afstandssensor (03517BT) en de benodigde PC om CoachLab op aan te sluiten. |
|
Uitvoering:
| In de bijgeleverde (Duitstalige) handleiding worden veel experimenten beschreven die men met de verschillende basisonderdelen (motor, zonnecel en brandstofcel) die in de experimenteerdoos aanwezig zijn kan uitvoeren. Ook wordt uitvoerig ingegaan op de achtergrond van de brandstofcel, zonnecellen en de waterstofeconomie. | |
|
|
|
|
|
|
|
|
|
|
|
|
| Bepalen van de snelheid | |
| De ultrasone snelheids meter geeft pulsen van ultrasone geluidsgolven af. Deze geluidsgolven bewegen zich voort in een kegelvormige gebied onder een hoek van 15 tot 20° van de centrale as van de golf. |
 |
| De bewegingsmelder "luistert" vervolgens naar de echo van de ultrasone geluidsgolf die teruggekaatst worden. De sensor meet vervolgens hoe lang het duurt voor een ultrasone geluidsgolf om zich van de sensor af te bewegen en door een voorwerp teruggekaatst te worden. Door deze tijdmeting te koppelen aan de snelheid van het geluid in lucht kan men de afstand tot het dichtsbijzijnde voorwerp bepalen. | |
Resultaten:
|
|
YouTube link: waterstof auto |
|
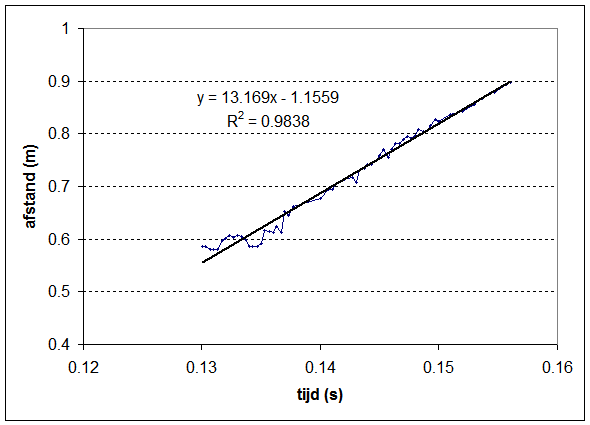
Er zit bijna een jaar tussen de linker foto en het rechter filmpje. De foto is gemaakt terwijl het wagentje reed. Een jaar later kon ik wel de wielen laten draaien mbv de brandstofcel maar kwam er te weinig vermogen op de wielen om de wagen te laten voortbewegen, zelfs als ik de zonnecel eraf haal. Mbv coachlab en de ultrasone snelheidsmeter heb ik indertijd wel de snelheid bepaald waarmee de auto zich voorbeweeg. Het meetresultaat is weergegeven in onderstaande grafiek waarin de afgelegde afstand als functie van de tijd wordt weergegeven. |
|
|
|
|
Uit de regressielijn kunnen we de gemiddelde snelheid van de waterstofauto zich afleiden: (1+1.1559)/13.169 = 0.16 m/s |
|
Literatuur:
Relevante websites: Minder relevante websites: |
Achtergrondinformatie:
| De zonnecel |
|
Een fotovoltaïsch systeem (zonne-cel) produceert elektriciteit uit zonlicht. De zonnecel is in wezen een halfgeleiderdiode (zie beneden). Een zonnecel bestaat uit een dun plaatje in halfgeleidend materiaal waarin vrije elektrische ladingen ontstaan wanneer er licht op invalt. In de halfgeleider is een inwendig elektrisch veld gecreëerd waardoor positieve en negatieve ladingen van elkaar kunnen gescheiden worden. Wanneer een belasting wordt aangelegd tussen de negatieve boven- en positieve onderkant van de zonnecel, zal hierdoor een gelijkstroom vloeien.
Het resultaat is een elektrische cel met een bepaalde elektromotorische kracht, EMK, die elektrische arbeid kan verrichten. De efficiëntie van de omzetting van stralingsenergie in elektrische energie hangt af van de aard van de straling en van de constructie en het materiaal van de cel. Voor een grote efficiëntie moet men voorkomen dat de elektronen de gaten weer opvullen (waarbij het ingevallen licht vrijkomt) voordat ze aan weerszijden het oppervlak van de cel bereiken. De energie-opbrengst zal ook veel groter zijn als de cel zoveel mogelijk licht absorbeert. De theoretische limiet voor het omzettingsrendement, ofwel de hoeveelheid verkregen elektrische energie per hoeveelheid zonnestralingsenergie, bedraagt voor monokristallijne siliciumcellen ongeveer 25% en voor galliumarsenidecellen 28%. Nu blijkt dat niet elk materiaal licht met dezelfde golflengte absorbeert. Het ene materiaal heeft een voorkeur voor UV-licht met een golflengte van 350 nm, het andere materiaal absorbeert gemakkelijker licht met een iets grotere golflengte. Een combinatie van materialen kan dan voor een hogere omzettingsefficiëntie zorgen. In het laboratorium zijn op die manier rendementen gehaald van meer dan dertig procent. De huidige generatie commerciële monokristallijne siliciumcellen heeft een efficiëntie van 10 tot 15%. Een dergelijke cel met een doorsnede van tien centimeter geeft onder ideale, heldere buitenomstandigheden, een stroom van twee ampère bij een potentiaalverschil van een half volt, dus een vermogen van één watt. |
| De
brandstofcel |
|
In een brandstofcel maken we gebruik van een elektrochemische reactie waarbij elektronen en dus elektricteit geproduceerd wordt, zolang we de brandstofcel van zuurstof (lucht) en waterstof blijven voorzien. De meest veelbelovende brandstofcel is de PEM (proton-exchange membrane ook wel polymer electrolyte membrane of protonuitwisselingsmembraan genoemd). Een PEM brandstofcel produceert vermogen (electriciteit) door de reactie van waterstof met zuurstof (lucht) tot water. Uit de uitlaat komt stoom (water), zodat de voertuigen ‘schoon’ zijn. De PEM is opgebouwd uit een sandwich van twee dunne poreuze elektrodes, een anode en kathode, met daartussen een polymeer membraan dat fungeert als een elektroliet (2-7 vellen papier dik). Een platina ruthenium katalysator coating zit op een zijde van elke electrode. Nadat waterstof moleculen de brandstofcel binnenkomen splitst de katalysator op de anode ze in elektronen en protonen. De elektronen worden afgedragen aan de platine katalysator terwijl de protonen door het membraan heen bewegen (proton exchange) . De elektronen bewegen langs een extern circuit (stroomdraad). Als de elektronen via een stroomdraad te lopen ontstaat een elektrische spanning en zo kan men dan weer bv een elektrische motor aa ndrijven. De protonen migreren door het membraan naar de kathode. De katalysator op de kathode combineert protonen met de terugkerende elektronen en met zuurstof uit de lucht waarbij water en warmte geproduceerd worden. Door cellen op elkaar te stapelen worden hogere voltages verkregen.
|
|
Electrochemische energie converteert waterstof (H2) en zuurstof (O2) in water (H2O). Door deze inwendige elektrochemische reactie ontstaat een potentiaalverschil tussen de elektroden. waarbij electriciteit en (!) warmte geproduceerd wordt. Oxidatie: 2H2 à 4H+ + 4e Reductie: 4e + 4H+ + O2 à 2H2O Overall Reactie: 2H2 + O2 à 2H2O Om de kinetiek van zowel de anode- als de kathodereactie te bevorderen maakt men gebruik van de platina ruthenium katalysatoren. Vooral de relatief trage reductie van zuurstof aan de kathode bepaalt de kinetiek van de celreactie. De platina ruthenium katalysator is echter ook zeer gevoelig voor verontreinigingen zoals bv zwavel. De levensduur van een brandstofcel wordt vnl bepaald door de verontreinigingen waar het mee in aanraking komt, die vervolgens op de katalysator belanden en deze vergiftigen. Aangezien brandstofcellen niet gebaseerd zijn op een verbrandingsproces worden er minder emissies gegenereerd dan het schoonste verbrandingsproces dat we kennen. Toch moet nog een aantal problemen overwonnen worden voordat auto’s met een brandstofcel in het straatbeeld te zien zullen zijn. De brandstofcellen zijn duur vergeleken met conventionele verbrandingsmotoren. Door massaproduktie zouden de kosten echter mogelijk omlaag gebracht kunnen worden. Een ander probleem is dat het erg moeilijk om een grote hoeveelheid waterstof in een auto op te slaan door de zeer lage dichtheid die waterstof heeft, hetgeen de actieradius van deze auto’s momenteel dus nogal beperkt maakt vergeleken met “normale” brandstofauto’s. Dat is een van de redenen dat men ook onderzoek doet naar auto’s die de waterstof “on-board” maken uit een vloeibare brandstof. |
11-01-2017