

| Kinetische analyse van de Jood Aceton reactie |  |
 |
Datum: Januari 2011
Principe:
| Kinetiek bepalen van de reactie van Jood met aceton |
Materiaal:
|
|
Uitvoering:
|
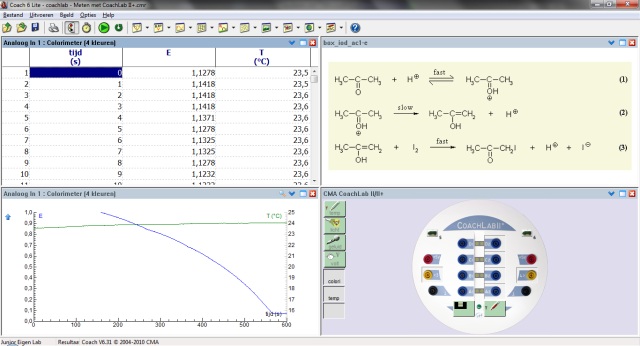 |
Resultaten:
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| EXP1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 |
 |
 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
| EXP2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 |
 |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
| EXP3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 |
 |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
| EXP4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 |
 |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
| EXP5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 |
 |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
| EXP6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
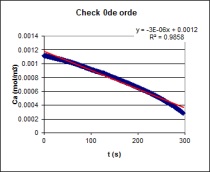
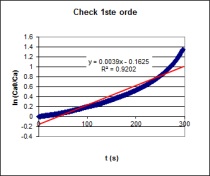
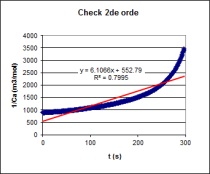
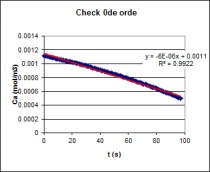
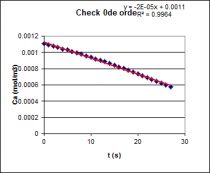
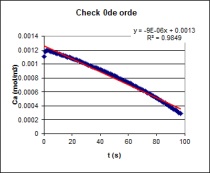
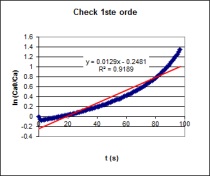
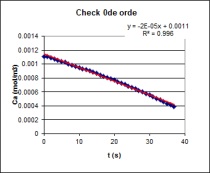
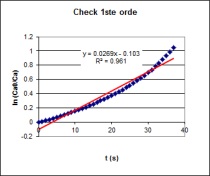
| Op basis van bovenstaande grafische analyse kan men
concluderen dat men met een 0de orde reactie te maken heeft.
Na deze analyse uitgevoerd te hebben
berekenen we m.b.v. Excel's SLOPE functie de hellingshoek van de
initiŽle reactiesnelheid van de 0de orde reactie. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Discussie en conclusie:
| In dit experiment kan de
snelheid waarmee de joderings reactie verloopt bepaald worden door 3
concentraties te variŽren, de aceton concentratie, de jood concentratie en
de hoeveelheid zuur (dat als katalysator fungeert. De algemene reactiesnelheids vergelijking zou men dan als volgt kunnen formuleren: r = k.[Ac]a[I2]i[HCl]h |
|||||||||||||||||||||||||||||||||||||||
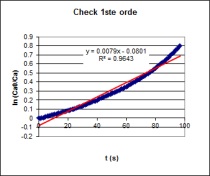
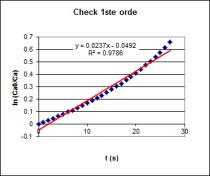
| De grafische analyse laat zien dat deze reactie 0-de orde in Jood is. | |||||||||||||||||||||||||||||||||||||||
| M.b.t. tot de bepaling van de reactiesnelheids constante kunnen we onderstaand overzicht produceren. | |||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||
| We kunnen zien dat de gevonden waardes grofweg een factor 3-5 verschillen met de waardes die in de literatuur te vinden zijn. Ik vermoed dat dit verschil voornamelijk toe te schrijven is aan mijn niet zo nauwkeurige concentraties van de stockoplossingen. | |||||||||||||||||||||||||||||||||||||||
| In de literatuur kan men onderstaand reactiemechanisme vinden. De tweede stap is dan de snelheidsbepalende stap. | |||||||||||||||||||||||||||||||||||||||
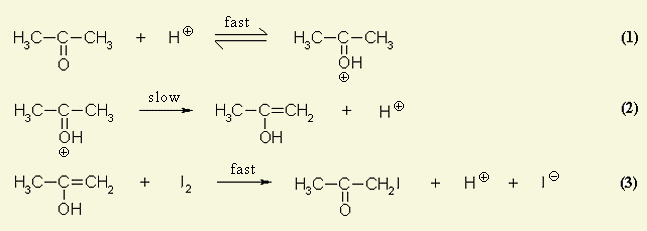 |
|||||||||||||||||||||||||||||||||||||||
| Bij deze reactie vind een elektrofiele substitutie plaats. De enol vorming is de langzaamste reactie en vormt dus de snelheidsbepalende stap in de reactie. De reactie van het jood met het enol vind zeer snel plaats (p-complex). In eerste instantie vormt zich een s-complex onder afsplitsing van I-. Het s-complex zet zich door deprotonering om in joodaceton. Aangezien Jood niet bij de langzame enol vorming betrokken is is de reactie 0de orde in voor Jood, terwijl men voor Aceton en HCl een reactie orde van 1 zal vinden. |
Opmerkingen:
|
Literatuur:
Relevante websites: |
Achtergrondinformatie:
|
In de
reactorkunde hebben we met de behoudswetten te maken, meer specifiek de
wet van behoud van massa.
Voor de
stofbalans geldt dan in woorden:
(de
toename per tijdseenheid van de massa van een open systeem) =
(massadebiet instroom) Ė (massadebiet uitstroom)
In
formule:
Op grond
van de deze wet van behoud van massa kan men voor individuele
componenten een component balans opstellen.
In
woorden:
Kortweg:
Accumulatie = Input Ė Output + Productie
Een massa
balans kunnen we in een mol balans omzetten door te delen door te delen
door de molmassa van A.
FA
is de mol flux
We hebben
in het experiment te maken met een zgn batch reactor, een afgesloten
systeem met constant volume, hetgeen betekent dat er geen invoer of
uitvoer plaatsvindt:
Om de
reactiesnelheidsterm RA te beschrijven maken we gebruik van
de reactiekinetiek.
Ra=-kCaaCbb
(mol/(m3.s))
Als a = b
= 1: 1ste orde in A en 1ste orde in B, overall
een 2de orde reactie.
Aangezien
V constant is:
Hetgeen
voor een 1ste orde reactie in een batchreactor betekent:
Analoog
kunnen we afleiden dat voor een irreversibele 0de orde
reactie geldt:
En dat
voor een irreversibele 2de orde reactie geldt:
Door nu
steeds deze relaties grafisch uit te zetten en kijken of deze een rechte
lijn opleveren kunnen we bepalen met welke reactieorde we te maken
hebben. Men spreekt dan van de integrale methode.
De
reactiesnelheidsconstante k is geen echte constante maar is wel
onafhankelijk van de concentratie van de reagerende componenten. Men
refereert ook wel naar deze constante als de zgn. specifiek reactie
snelheid (s constante). Deze constante is altijd sterk afhankelijk van
de temperatuur. In gas fase reacties is deze ook nog afhankelijk van de
katalysator en eventueel van de totaaldruk. Volgens Arrhenius wordt de
temperatuurafhankelijkheid van de reactie weergeven door de zgn
Arrhenius vergelijking:
Waarin: Om de Arrhenius vergelijking te kunnen gebruiken om de reactieconstante te bepalen is het noodzakelijk om het experiment bij verschillende temperaturen uit te voeren. In dit geval hebben we het experiment maar bij een temperatuur uitgevoerd.
In een
situatie waar de reactie irreversibel is en de reactiesnelheid
afhankelijk is van de concentratie van een component kunnen we de zgn
differentiŽle methode gebruiken waarbij we de reactie bestuderen als een
van de componenten in overmaat aanwezig is.
Indien: Aŗ
P
Dan: Ra=-kCaa
Hetgeen we
analoog aan hierboven kunnen omwerken naar:
Door deze vergelijking grafisch uit te zetten kan men dus de reactiesnelheidsconstante en de orde van de reactie bepalen. Om dit op een redelijk betrouwbare manier te kunnen doen kan men echter alleen de initiŽle data gebruiken waarin A nog in overmaat aanwezig is. |
||||||||
16-01-2017