Bepalen van het getal van Avogadro mbv elektrolyse


|
Bepalen van het getal van Avogadro mbv elektrolyse |

|

|
Datum: juli 2008
Principe:
| Het getal van Avogadro is niet een getal dat men wiskundig kan afleiden. Men kan het aantal deeltjes dat een mol vomen alleen experimenteel bepalen. In dit experiment maken we gebruik van elektrochemie. Het getal van Avogadro is gedefinieerd als zijnde het aantal atomen in exact 12 g van het isotoop 12C hetgeen 6.02214199 x 1023 is. |
Materiaal:
|
|
 |
|
Uitvoering:
|
|
|
|
|
|
|
|
|
|
Resultaat:
| In totaal heb ik vier experimenten uitgevoerd. De resultaten zijn weergegeven in onderstaande screenshot. | |
|
|
|
De meetgegevens zijn samengevat in onderstaande tabel: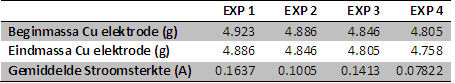 \ \
Tijdens het experiment zien we ook een aanzienlijke waterstof ontwikkeling. |
 |
Discussie:
|
In dit experiment hebben we gebruik gemaakt
van een elektrochemische proces genaamd elektrolyse. Bij elektrolyse
gebruiken we een externe energiebron om een reactie op gang te brengen die
anders niet plaats zou vinden.
Een mol wordt gedefinieerd als de atomaire massa van een element in grammen. In dit experiment meten we elektronen flow (Amperage of stroom) en tijd om zo het aantal elektronen te verkrijgen dat door de elektrochemische cel stroomt. Het aantal atomen in een afgewogen monster gerelateerd aan de elektronen flow maakt het mogelijk om het getal van Avogadro te berekenen. In deze elektrolytische cel zijn de elektrodes opgebouwd uit koper en zink en het elektrolyt zwavelzuur. Gedurende de elektrolyse is de koper elektrode verbonden met de positieve pool van de voedingsbron en de zink elektrode met de negatieve pool. In deze periode worden koper atomen geconverteerd naar koper ionen, de elektrode verliest massa hetgeen men kan zien aan de verruwing van het elektrode oppervlak en aan de blauwkleuring van het water. Cu --> Cu2+(aq) + 2e Aan de ander elektrode, de kathode, wordt waterstof gegenereerd door de reductie van de H+ ionen in de zwavelzure oplossing volgens> H+(aq) + 2e --> H2(g) Het principe van de elektrochemische cel is al behandeld in een eerder experiment: Elektrochemische cel Het getal van Avogadro berekenen we als volgt: De volgende metingen werden gemaakt voor
het eerste experiment: Per definitie: De resultaten van alle experimenten zijn samengevat in onderstaande tabel. |
|
|
|
De resultaten zijn slechter dan ik verwacht
had, de relatieve fout is erg groot. We kunnen echter wel concluderen dat de grootteorde van het getal dat we
gevonden hebben wel klopt (1023). Blijft de vraag waar die grote
fout door veroorzaakt wordt. We hebben uiteindelijk maar te maken met twee
meetgegevens te weten massa verlies en gemiddeld stroomverbruik. Voeren we
een gevoeligheids analyse uit dan blijkt als snel dat een kleine verandering
(in de tweede decimaal) in het massaverlies een groot effect heeft op het
berekende getal van Avogadro. Voor een min of meer vergelijkbaar effect
moeten we de gemiddelde stroomsterkte met een factor 10 vergroten. Deze
analyse in combinatie met de hoogst haalbare nauwkeurigheid van de balans
maakt het aannemelijk dat de belangrijkste fout veroorzaakt wordt door de
massametingen. Deze fout kunnen we kleiner maken door het experiment gedurende een langere periode te laten verlopen waardoor het massaverlies groter wordt en de fout kleiner. Een andere mogelijkheid is om een nog nauwkeuriger analytische balans te gebruiken (tot 0.1 mg nauwkeurig). |
Conclusies:
| Op basis van de experimentele resultaten vinden we een gemiddelde waarde voor het getal van Avogrado van 1.08 x 1023. De werkelijke waarde is 6.02 x 1023 hetgeen betekent dat we een relatieve fout van 82% hebben. |
Literatuur:
|
Relevante websites:
Minder relevante websites:
Opmerkingen:
|
Achtergrondinformatie:
|
In 1811 werd door Amedeo Avogrado, een Italiaanse
natuur- en wiskundige, een hypothese gepubliceerd in het tijdschrift "Journal
de Physique" getiteld "Essay over een manier om relatieve massa's te bepalen
van elementaire moleculen van lichamen en de verhouding waarin ze zich in
deze stoffen bevinden" waarin beweerd werd dat het volume van een gas recht
evenredig is met het aantal moleculen van dat gas. In formule: V = c.N waarin c een constante, V het gas volume en N het aantal gasmoleculen is. Op basis van deze formule kan men stellen dat identieke gas volumina hetzelfde aantal moleculen bevatten als druk en temperatuur ook gelijke aan elkaar zijn. |
|
|
Dit type correlatie was al eerder gepostuleerd (o.a. door Gay-Lussac) maar wat Avogrado's hypothese beter en correcter maakte was zijn definitie van een molecuul, zijnde het kleinst mogelijke karakteristieke deeltje van een stof hetgeen een elementair atoom mag zijn maar ook een permanente samensmelting van verschillende elementaire atomen mag zijn. Hij postuleerde dat sommige gassen zoals waterstof en zuurstof opgebouwd zijn uit twee-atomige moleculen en dat een water molecuul is opgebouwd uit drie elementaire atomen, twee waterstof en een zuurstof atoom. Het door Avogrado gepostuleerde concept koppelde Dalton's hypothese over atomen met Gay-Lussac's gas wet. Door het vergelijken van de massa van identieke volumes van verschillende gassen bij identieke temperaturen en drukken kan men de gewichtsverhoudingen van gas moleculen meten hetgeen de basis was van de eerste methode om op de juiste manier atoom massa's te meten. De combinatie van de wet van Boyle, de wet
van Charles (de 1ste wet van Gay Lussac) en de hypothese die door Avogrado
geformuleerd werd geeft de ideale gas wet: Avogrado's hypothese werd vervolgens genegeerd voor een periode van ca. 50 jaar. Een van de redenen was dat sommige geleerden (waaronder Dalton) het niet zo prettig vonden geconfronteerd te worden dat ze atoom massa's niet correct bepaald hadden. Pas nadat Cannizzaro in de periode 1858-1860 een systeem van atoom massa's presenteerde dat gebaseerd op Avogrado's hypothese werd deze geaccepteerd. |
|
15/01/2017