

| Elektrochemische Cel |  |
 |
Datum : september 2002
Principe:
Het bouwen van een eenvoudige DaniŽll cel m.b.v. Cu, Zn en hun sulfaatzouten.
Benodigd:
|
|
Werkwijze:
|
|
|
Meetresultaten:
|
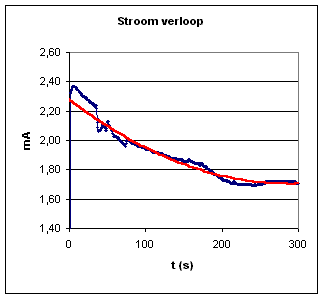
Het gemeten voltage is (zoals hierboven te zien is): 1.058 V Het gemeten amperage is niet constant maar neemt af in de tijd (zie de nevenstaande figuur, de blauwe punten zijn de meetwaarden, de rode lijn is een regressielijn, de nevenstaande figuur is een "snapshot").
|
 |
Discussie en conclusie:
|
|
In de linker
halfcel bevindt een Zn elektrode zich in een oplossing van zinksulfaat
(0.1 M). Rechts bevindt zich een Cu elektrode in een oplossing van
kopersulfaat (0.1 M). De deeltjes aan de linkerkant zijn Zn, Zn2+
en SO42-. De deeltjes aan de rechterkant zijn Cu, Cu2+
en SO42-.
We kunnen behulp van de wet van Nernst de standaardelektrodepotentiaal uitrekenen. |
||||||||
|
Voor de halfcel met de reductor geldt:
Voor de halfcel met de oxidator geldt:
De halfcel met de reductor heeft dus een potentiaal van -0.79 V. De halfcel met de oxidator heeft een potentiaal van +0.31 V. De bronspanning van de cel wordt gegeven door: DV =Vox-Vred = 0.31 - (-0.79) = 1.1 V We maten 1.058 V. Het verschil kunnen we toeschrijven aan een niet zo nauwkeurige balans (1 g) waarmee we de oplossingen hebben gemaakt. De concentratie kan daarom afwijken van 0.1M hetgeen het verschil verklaart. Het stroomverval dat we gemeten hebben is waarschijnlijk het instellen van de dubbellaag rond de elektrodes. Dit is aannemelijk aangezien het verval afvlakt. Indien we teveel reactanten verbruikt hebben verwacht ik dat het meer lineair naar beneden gaat. |
|||||||||
Opmerkingen:
|
Literatuur:
Relevante websites: |
Achtergrondinformatie:
|
Om elektrodeprocessen te kunnen
bestuderen moeten we de beschikking hebben over een elektrochemische cel. Deze
bestaat in zijn eenvoudigste vorm uit twee geleiders (elektroden) geplaatst in
een vat gevuld met elektrolytoplossing. Bij stroomdoorgang door een dergelijke
cel moeten aan de elektroden reacties plaatsvinden waarbij de lading in de vorm
van elektronen of ionen het grensvlak elektrode/oplossing passeert. De elektrode
waaraan oxidatie plaatsvindt wordt anode genoemd, de elektrode waaraan reductie
plaatsvindt heet kathode.
Voor de kathodische reactie:
De bruto celreactie wordt dan:
Stroomdoorgang kan alleen plaatsvinden indien er een gesloten circuit bestaat. We moeten beide elektroden daarom uitwendig met elkaar verbinden. Levert een elektrochemische cel bij het tot stand komen van dit elektrisch contact spontaan stroom, dan spreken we van een galvanische cel. In dit geval wordt de chemische energie omgezet in elektrische energie (accu!). Indien daarentegen een uitwendige spanningsbron moet worden aangesloten om stroom door de cel te doen vloeien, dan spreken we van een elektrolytische cel. Hierbij wordt elektrische energie omgezet in chemische energie (accu opladen). De celreactie verschilt alleen daarin van een normale redoxreactie in oplossing, dat de elektronen nu niet direct van het ene deeltje op het nadere worden overgedragen maar via een uitwendig circuit. |
08-01-2017