Avonturen met mijn
Jet-Net handwarmer


|
Avonturen met mijn |
 |
 |
|
Principe: |
| Inleiding: | |
| De primaire vraag die ik me gesteld heb is
of ik experimenten kon bedenken die het mogelijk maakten om zoveel mogelijk
gegevens te verzamelen en op die manier ook de stof die in handenwarmer zit
te identificeren.
|
 |
Al met al heb ik de volgende
experimenten/vragen bedacht waaraan ik wil werken:
|
|
Materiaal:
|
|
|
|
Uitvoering:
| Filmpje van het kristallisatieproces | |
|
|
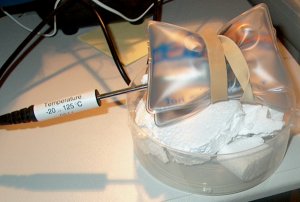
| Hoe warm wordt de handwarmer? | |
|
|
|
 |
 |
|
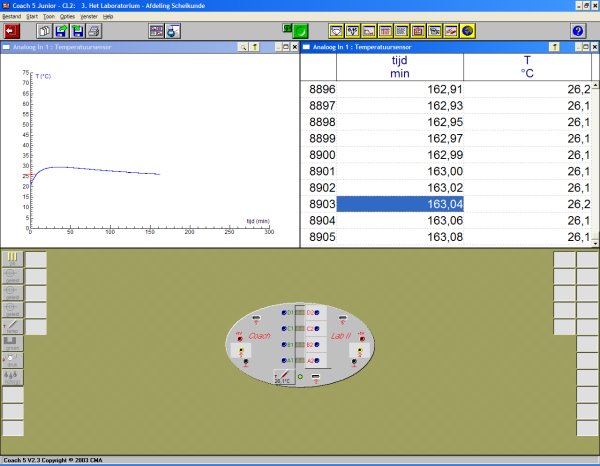
| Kristallisatiewarmte bepalen mbv een zelfgebouwde calorimeter | |
|
Om de hoeveelheid warmte die door het kristallisatieproces afgegeven wordt te bepalen maken we gebruik van een eenvoudige calorimeter. Het kenmerk van een deze calorimeter is dat we de warmteafgifte naar de omgeving proberen te minimaliseren. Bepalen van de kristallisatiewarmte:
Bepalen van de warmtecapaciteit van de calorimeter:
Tot slot:
|
|
|
|
 |
| Water wegen en opwarmen | De opstelling |
| Chemische identificatie | |
|
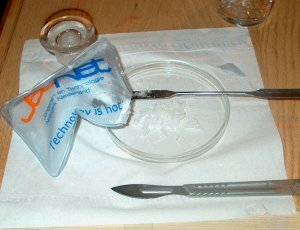
Openen van de handwarmer |
|
|
 |
|
Vlamproef - aantonen van Natrium |
|
|
 |
|
|
|
Aantonen van acetaat-ionen |
|
|
|
|
Aantonen van azijnzuur |
|
|
 |
| Regeneratie van de Handwarmer | |
|
|
| Bestuderen van het plaatje onder de microscoop | |
|
|
Resultaten:
| Filmpje van het kristallisatieproces | |
|
Zoals jullie zien is het niet moeilijk om een filmpje van het kristallisatieproces te maken. |
YouTube link: Handwarmer |
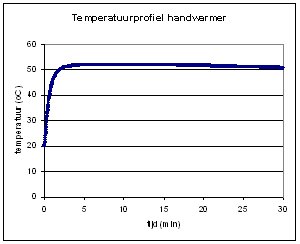
| Hoe warm wordt de handwarmer? | |
|
De maximale temperatuur die
op deze manier gemeten is is 52.3 oC. |
 |
| Kristallisatiewarmte bepalen mbv een zelfgebouwde calorimeter | |
| Data en berekeningen zijn opgeslagen in de excel sheet: handwarm.xls | |
|
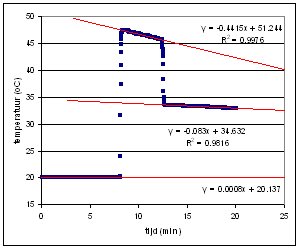
Bepalen van de warmtecapaciteit van de calorimeter. In de grafiek hiernaar zie je het resultaat van de data verzameld tijdens de warmtecapaciteits bepaling van de calorimeter. Voor het gemak zijn er regressielijnen door de verschillende datapunten getrokken. Deze maken het makkelijk om op een bepaald tijdstip de bijbehorende temperatuur te berekenen. We maken bij de berekeningen
gebruik van de formule:
q = Cp.m.DT
|
|
|
Op deze manier kunnen we
berekenen:
|
Data: Warm water: 102.1 g Koud water: 102.4 g Specifieke Warmtecapaciteit H2O: 4.18 J/(g.oC) Temperaturen ten tijde van het mengen (berekend op t=13 min): Warm water 45.5 oC Koud water 20.1 oC Mengtemperatuur 33.6 oC |
|
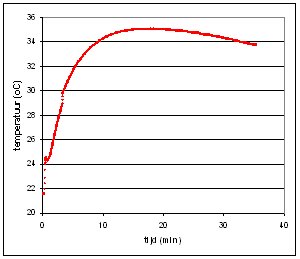
Kristallisatiewarmte bepalen In de grafiek hiernaast wordt het meetresultaat weergegeven. Een van de zaken die we ons bij het uitwerken van de data moeten realiseren is dat we niet alleen maar het water maar ook de hotpack zelf die uit natriumacetaat (NaAc) en water bestaat. De vraag is echter hoeveel van beide er in het hotpack zitten. De oplosbaarheid van NaAc in water is 46.4 g/100 ml bij 20 oC. Zoeken we het patent op (Zie achtergrondinformatie) dan ontdekken we dat men daarin praat over een oplossing die voor de helft uit NaAc en voor de helft uit water bestaat, hetgeen dus een oververzadigde oplossing is. Dit gegeven gebruiken we in onze berekeningen. |
 |
|
Meetdata: |
Basic Data: Molmassa NaAc: 82.03
g/mol |
|
Berekening: Met: 49.5 g NaAc = 49.5/82.03
= 0.6 mol NaAc. |
|
| Chemische identificatie | |
|
Vlamproef - aantonen van Natrium |
|
 |
 |
| Uitgloeien |
De vlam wordt geel. |
|
Aantonen van acetaat-ionen. |
|
|
De test heb ik uiteindelijk uitgevoerde mbv een zelf gemaakte oplossing van Ferri-chloride (Fe(III)Cl3). (zie achtergrond informatie) In de rechterbuis zit het zelfgemaakte materiaal. In de linkerbuis zit de acetaatoplossing waar de groenige oplossing aan is toegevoegd. Goed is te zien dat de oplossing oranje is geworden. De bodem van deze buis bevat ook nog een donkerbruin/donkerrood neerslag. Deze oranje kleur geeft aan dat er acetaationen aanwezig zijn in onze oplossing. In deze aantoningsreactie wordt ijzeroxide (Fe2O3) gevormd die de oplossing zijn kleur geeft. Hoe deze reactie precies verloopt heb ik nog niet kunnen achterhalen. Ik vermoedt een redoxreactie. |
 |
|
Aantonen van azijnzuur |
|
|
Het poeder zelf is reukloos. De gedachte achter dit experiment is dat we door het toevoegen van een zuur het natrium acetaat weer veranderen in het azijnzuur van waaruit het oorspronkelijk gemaakt is volgens: 2CH3COO- + 2Na+
+ 2H3O+ + SO42- <=> Door nu te refluxen scheiden we het azijnzuur van de zwavelzuur. Alleen het azijnzuur en water stijgen op in de refluxbuis, het zwavelzuur blijft achter. Als het azijnzuur het pH papiertje raakt geeft het pH papiertje aan dat we met een zuur te maken hebben zoals hiernaast te zien is. Door er vervolgens aan te ruiken nemen we de typische azijnzuurgeur waar. |
|
| Regeneratie van de Handwarmer | |
 |
 |
 |
 |
 |
Zoals we kunnen zien kunnen we een gebruikte handwarmer inderdaad regenereren in een pannetje met warm water. De kristallen verdwijnen en we krijgen weer een oplossing. Laten we het plaatje vervolgens weer knakken dan start de kristallisatie weer. |
| Bestuderen van het plaatje | |
 |
 |
|
plaatje 10 x vergroot (bovenverlichting) |
plaatje 60 x vergroot (bovenverlichting) |
 |
 |
|
plaatje 60 x vergroot (bovenverlichting) |
plaatje 200 x vergroot (bovenverlichting) |
|
Onder microscoop blijkt dat de gleuven in de plaatjes dicht zitten. We kunnen echter ook zien dat er fijne scheurtjes in het metaal zijn ontstaan. |
|
| Discussie:
Zoals te zien is op deze website is het niet moeilijk om een filmpje van het kristallisatieproces te maken. De hoogste temperatuur die we gemeten hebben op is 52 oC. Op het internet heb ik het getal 54 oC gevonden. Al met al liggen deze getallen dicht genoeg bij elkaar. De manier van meten kan invloed uitoefenen op het uiteindelijke resultaat en de ijking van de thermometer is uiteraard ook een factor die invloed kan uitoefenen op het uiteindelijke resultaat. Met behulp van enkele chemische aantoningsreacties hebben we aangetoond dat de vloeistof in de handwarmer natriumacetaat is. De werking van de handwarmer berust nu
op een fase verandering waarbij warmte vrijkomt. In dit geval is
dat de kristallisatie van natrium acetaat volgens: Het gegeven dat men met natriumacetaat vrij makkelijk een oververzadigde oplossing kan maken is ook af te leiden uit het regenereerbaar zijn van de handwarmer in een pannetje met water dat verwarmd wordt. Op die manier kunnen we de handwarmer weer gebruiken. Blijven we over met de vraag hoe het kristallisatieproces op gang gebracht wordt met het metalen plaatje. Voor kristallisatie hebben we een externe "trigger" nodig. Dat kan op een aantal verschillende manieren, te weten:
In de Jet-Net handwarmers die we gebruiken zit een metalen plaatje dat je moet laten knakken om de kristallisatie op gang te brengen. De vraag is dus hoe het laten knakken van deze plaatjes de kristallisatie op gang kan brengen. In eerste instantie kun je niet zeggen welke van bovenstaande verklaringen de beste lijkt te zijn. Het microscopisch onderzoek heeft echter laten zien dat er scheurtjes ontstaan in het metalen plaatje. Op basis van die observatie lijkt de drukpuls theorie nu het minst waarschijnlijk te zijn. Blijft over de metalen deeltjes en het ruwe oppervlak. Een argument dat tegen de metalen deeltjes gebruikt kan worden is het idee dat deze deeltjes in de oplossing blijven zweven en daardoor na regeneratie en afkoeling eigenlijk onmiddellijk weer als entkristal zouden fungeren. Dit argument zou echter ook tegen het ruwe oppervalk gebruikt kunnen worden. Daarnaast bestaat er de mogelijkheid dat de ijzerdeeltje zich gaan vasthechten aan het plastic van het zakje en dus helemaal niet in de oplossing gaan rondzweven. Deze laatste redenatie is niet toepasbaar op het ruwe oppervlak hetgeen dus weer kristallisatie zou bevorderen tijdens het afkoelen. Op basis van deze enkele observatie en de speculatieve redenaties gaat mijn voorkeur dus uit naar de ijzerdeeltjes theorie. Bewezen hebben we het echter niet. Ik hen verder niets kunnen verzinnen om met de mij ter beschikking staande middelen dit verder uit te zoeken. |
| Werner Tenge stuurde mij op 9 maart 2009 een andere mogelijke verklaring voor de werking van het plaatje: |
| In uw stukje over de Natrium Acetaat
handwarmer vraagt u zich of hoe het plaatje metaal zorgt voor het enten of
starten van het kristallisatie proces. Ik dacht hierop een mogelijk
antwoord te hebben gevonden. Het klikken van het plaatje veroorzaakt een
kleine cavitatie zone. Aan de randen van deze zone of 'bel' is de
dampspanning zeer laag, zoals het kookpunt van water op grote hoogte ook
sterk verlaagd is. Op deze kleine schaal vind dus een effect plaats
waarbij een sterke agitatie/versnelling gekoppeld wordt aan een sterke
oververzadiging: een weinig water verdampt heel snel aan de randzone van
de cavitatiebel, en dwingt zo een kristalpunt tevoorschijn. Mocht u er
ondanks de (in lucht) hoorbare klik* van overtuigd zijn dat er geen
cavitatie optreedt, met geluidsgolven kunnen PCM's aangezet worden tot
kristallisatie. Dit wordt momenteel aan de UT onderzocht. Geluidsgolven
bestaan natuurlijk uit verdichtingen en verdunningen van het medium die
bepaald geen cavitatie veroorzaken, toch is deze vorm van agitatie
voldoende om kristallisatie te starten. Daarbij kan natuurlijk nog steeds
gebruik gemaakt worden van ent-deeltjes, of zelfs gebogen oppervlaktes die
geconcentreerde zones opleveren waarin genoeg energie gebundeld wordt. * ouderwets kinderspeelgoed: de blikken klik-kikker |
|
Conclusies:
Opmerkingen:
Literatuur:
Relevante websites: Minder relevante websites |
Achtergrondinformatie:
| Het handwarmer patent | |
| Je kunt er natuurlijk zeker van zijn dat iemand een patent heeft genomen op deze handenwarmers en dat is inderdaad zo. Je kunt vrij gemakkelijk zo'n patent inkijken via de site van Esp@cenet alwaar je patenten kunt opzoeken. | |
|
|
|
|
|
|
|
|
|
|
| Bepalen van de hoeveelheid warmte | |
| Willen we iets te weten komen
over de hoeveelheid warmte die vrijkomt bij of nodig is voor een proces, dan
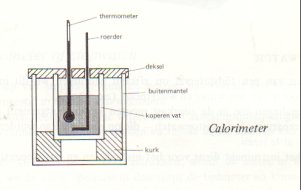
gebruiken we een calorimeter. Een calorimeter is een toestel waarbij de
warmte-uitwisseling met de omgeving tot het uiterste wordt beperkt. Zo wordt
er voor allerlei bepalingen (soortelijke warmte, verdampingswarmte,
smeltwarmte, etc.) gebruik gemaakt van een calorimeter. In principe kan men reeds warmte meten mbv een metalen bakje met een dunne wand. Dit bakje wordt dan op een laagje plastic gezet. In het bakje worden een thermometer en een roerder geplaatst. Verder is het bakje met water gevuld. Door het water te roeren wordt ervoor gezorgd dat de temperatuur overal in het bakje gelijk is. Een laboratorium calorimeter lijkt erg veel op bovenstaande opstelling er zijn echter een paar belangrijke verschillen. Het belangrijkste onderdeel is een koperen bak. Deze bak is omgeven door een tweede bak, zodat er een isolerende luchtlaag ontstaat hetgeen resulteert in een minimum aan warmte-uitwisseling met de omgeving. Daarom is de binnenste bak een laag kurk geplaatst en is het geheel afgeschermd door een deksel van perspex, waardoor een thermometer en een roerder kunnen worden gestoken. |
|
| De roerder heeft de vorm van een ring zodat bij het op en neer bewegen de vloeistof tot stroming wordt gebracht. Hierdoor vindt er een snelle en gelijkmatige warmteverdeling plaats. Daar de calorimeter, de thermometer en de roerder, bij menging van twee stoffen van verschillende temperatuur, temperatuurveranderingen ondergaan , moet het aantal Joule dat de calorimeter met toebehoren, per graad temperatuurstijging opneemt (dit is de warmte capaciteit van de calorimeter) bepaald zijn. Bij het verrichten van metingen met de calorimeter moet er op toegezien worden dat de begin- en eindtemperatuur van de calorimeter zo worden gekozen, dat deze symmetrisch liggen tov de kamertemperatuur. |
 |
| Dit om eventuele
warmte-afgifte aan en warmte-opname van de omgeving zoveel mogelijk aan
elkaar gelijk te maken, waardoor de hierdoor optredende fout zo klein
mogelijk wordt gehouden.
De warmteafgifte of warmteopname q
naar of van een massa m is gerelateerd aan de te
temperatuursverandering DT
volgens: q = Cp.m.DT Voor water: Cp = 4.18
J/(g.oC) |
|
Literatuur:
|
|
| Het maken van een Ferri-chloride oplossing | |
| Aangezien ik zelf momenteel geen ijzerchloride tot mijn beschikking had bedacht ik dat ik er zelf een makkelijk moest kunnen maken door gewoon wat ijzerpoeder in zoutzuur op te lossen. Dit bleek echter niet zo eenvoudig te zijn. | |
| Na wat ijzerpoeder in zoutzuur gestrooid te hebben zag ik gasvorming (Waterstof) die urenlang aanhield en vergezeld ging van een nare geur (vermoedelijk H2S, tgv verontreinigingen in het Fe). Ik kreeg niet het gevoel dat ik hier een oplossing van Ferri-chloride (Fe(III)Cl3) aan het maken was. Na in de literatuur gekeken te hebben werd dit vermoeden bevestigd. Men maakt nl Ferro-chloride (Fe(II)Cl2). Wederom volgens de literatuur kan men echter Ferro-chloride omzetten in Ferri-chloride door het met chloor te laten reageren. Daarom heb ik glorix toegevoegd hetgeen waarschijnlijk een mengsel van Ferro- en Ferri-chloride gemaakt heeft waarmee we alsnog de acetaat aantoningsreactie hebben kunnen uitvoeren. |
|
Literatuur:
|
|
27-12-2009