Liesegang ringen


|
Liesegang ringen |

|

|
Datum: Februari - Maart 2007
Principe:
| Een complex reactie-diffusie patroon creeeren. |
Materiaal:
|
|
Uitvoering:
|
|
Resultaat:
| Reactiebuis | |||
 |
 |
 |
 |
| dag 1 - 14:21 | dag 1 - 15:21 | dag 1 - 18:17 | dag 2 - 08:41 |
 |
 |
 |
 |
| dag 2 - 10:44 | dag 3 - 17:25 | dag 4 - 15:06 | dag 5 - 16:03 |
 |
 |
 |
 |
| dag 6 - 18:04 | dag 8 - 05:32 | dag 11 - 16:27 | dag 12 - 17:33 |
 |
 |
 |
 |
| dag 14 - 15:59 | dag 16 - 17:27 | dag 18 - 17:29 | dag 23 - 20:03 |
 |
 |
  |
|
| dag 25 - 17:45 | dag 28 - 13:12 | Een zoom op de buis van dag 4 en dag 25 laat de ontstane ringen duidelijk zien. | |
|
|
|||
| Petrischaal | |||
|
|
|
||
|
dag 1 - 13:22 |
dag 1 - 14:10 | ||
 |
|
||
| dag 1 - 15:11 | dag 1 - 17:37 | ||
 |
 |
||
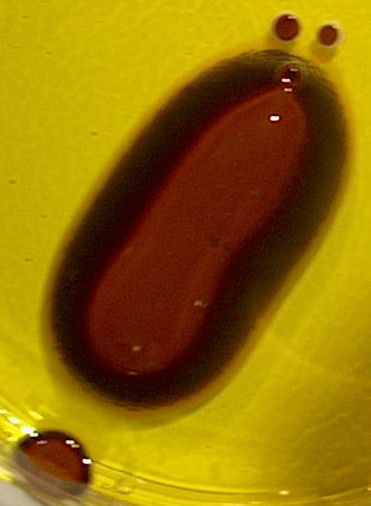
| dag 1 - 18:28 | dag 2 : 18:31 | ||
 |
 |
||
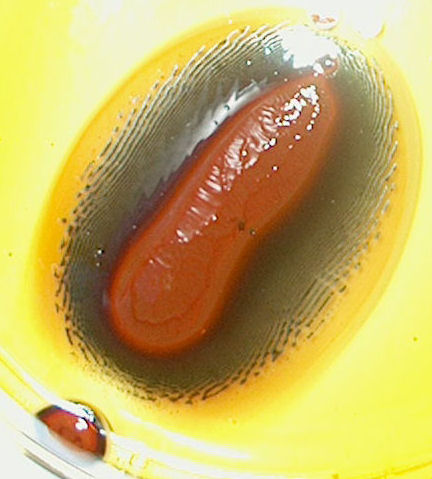
| dag 2 - 10:43 | dag 3 - 17:24 | ||
 |
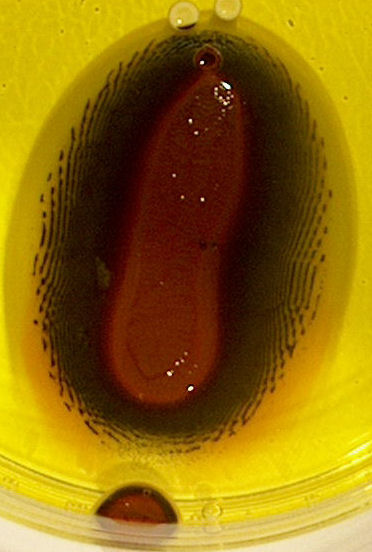 |
||
| dag 4 - 15:06 | dag 5 : 16:04 | ||
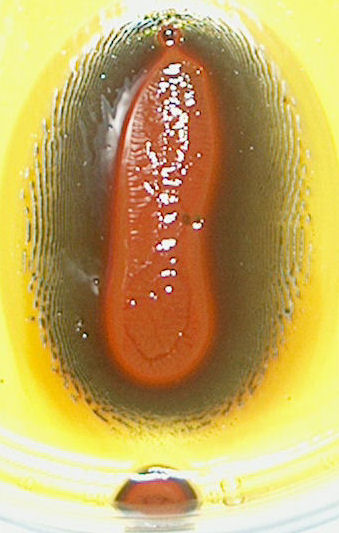 |
 |
||
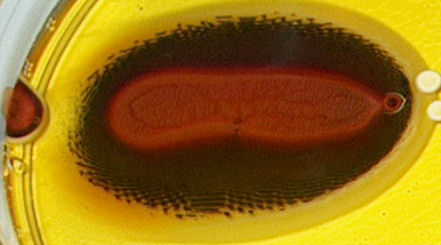
| dag 6 - 18:05 | dag 8 - 05:33 | ||
 |
 |
||
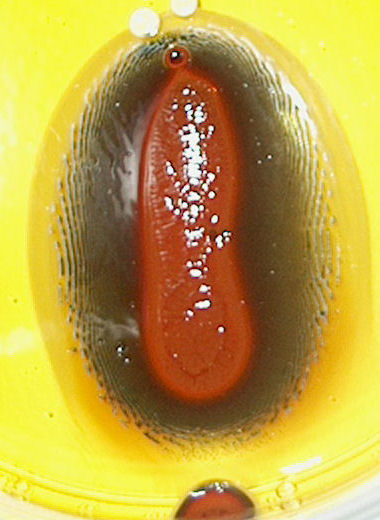
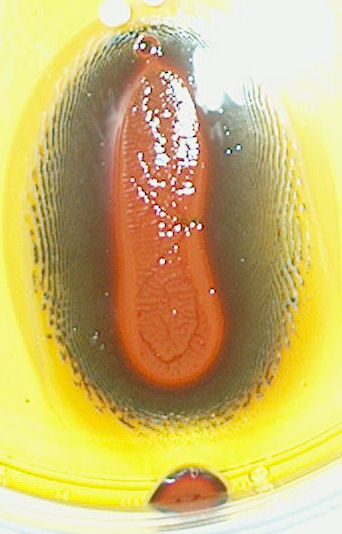
| dag 11 - 16:28 | dag 14 - 16:00 | ||
|
Ik heb de petrischalen uiteindelijk ook nog eens op een
scanner gelegd. Dat geeft iets duidelijker resulaten. |
|||
 |
 |
||
| Een kleine druppel op een andere petrischaal laat niet zulke mooie ringen zien. | De ringen van de grote vlek zijn op dit plaatje nog iets beter te zien. | ||
| De eindresultaten van de buisexperimenten. | |||
 |
|||
| Verz. AgNO3 opl. | ca. 0.05 M AgnO3 | Verz. CuSO4 opl. | Verz. ZnCl2 opl. |
| Zoals te zien is heeft alleen de verzadigde zilvernitraat oplossing een goed resultaat gegeven. | |||
Discussie en conclusie:
| Het fenomeen dat we in de foto's hebben zien ontstaan staat in de literatuur bekend als Liesegang ringen. Ze werden als eerste beschreven door Raphael E. Liesegang naar wie ze genoemd zijn. Men kan stellen dat de vorming van Liesegang ringen in nagenoeg elk chemisch systeem optreedt dat een precipitatie (neerslag) reactie ondergaat bij bepaalde concentraties en in afwezigheid van convectie. | |
| Als de chromaationene bevattende gel eenmaal vast is plaatsen we de zilvernitraat oplossing boven op de gel. De zilverionen diffunderen in de gel waar ze in contact komen met de chromaationen. Het gevormde zilverchromaat slaat neer. In reactie: | |
|
2Ag+ + Cr2O72- --> Ag2Cr2O7 (s) |
|
| Na enkele uren kunnen we observeren dat elk neerslag gebied (ring) gevolgd wordt door een gebied (ring) waar geen neerslag gevormd is en dit patroon herhaald zich waarbij een Liesegang ringen patroon ontstaat. Een andere observatie die we kunnen maken is dat bij de banden die het verst verwijderd zijn van de plaats waar de zilvernitraatoplossing is opgebracht de onderlinge afstand groter is dan de banden die dichter bij die plaats zijn. | |
| De vorming van Liesegang ringen kan men ook in de natuur bij mineralen waarnemen zoals onderstaande foto's demonstreren. | |
 |
|
| Alhoewel we het duidelijk is dat er een onoplosbaar neerslag gevormd wordt is de vorming van de ringstructuur helemaal niet zo makkelijk te verklaren. | |
| De
meer algemene verklaring die men kan vinden is: De vorming van Liesegang ringen vindt plaats als een geconcentreerde zoutoplossing door een waterig medium diffundeert dat opgenomen is in een gel laag waarin een ander zout in is opgelost. De chemische reactie tussen beide zouten vormt een zwak oplosbaar product dat discontinue neerslaat in banden die parallel lopen aan het diffusiefront. Er zijn grofweg twee modellen die dit fenomeen kunnen beschrijven: 1. Modellen die de bandvorming toekennen aan een feedback mechanisme tussen nucleatiekinetiek en de groei van het neerslag. 2. Modellen die de bandvorming toeschrijven aan post nucleatie instabiliteit (Lifshitz-Slyozov instabiliteit). |
|
| De verklaring die het meest wordt gegeven voor de vorming van Liesegang ringen is de zgn Ostwald-Prager theorie. Als de twee reactanten diffunderen zal er alleen homogene nucleatie optreden als een bepaalde kritsche oververzadigingwaarde wordt overschreden. Op dat moment zal de groei van de nucleatiekernen de nabije ionen opgebruiken, er treedt diffusielimitering op in de nabijheid van de kern. De vorming van de nucleatiekern verhinderd dus de vorming van nucleatiekernen in de nabijheid. Als de diffusie voortschrijdt wordt de kritsche oververzadigingconcentratie pas weer overschreden op een bepaalde afstand van het vorige nucleatiegebied. Een nieuwe band wordt gevormd en het proces zal door blijven lopen totdat een van de reactanten is verbruikt. | |
| Het
nadeel van bovenstaande tehorie is dat deze niet alle observaties verklaard
die in de loop der tijd gedaan zijn te weten: 1. De aanwezigheid van precipitaat deeltjes tussen de banden en hun inhomogene verdeling als er geen concentratiegradient aanwezig is. 2. Het model voorspeld niet hoe de reeds gevormde ringen veranderen en ook niet het ontstaan van complexe patronen die een dislokatie in het bandenpatroon laten zien. |
|
| Het moge duidelijk zijn dat er nog steeds geen allesomvattende theorie beschikbaar is die de vorming van Liesegang ringen in al zijn facetten beschrijft. | |
Literatuur:
Relevante websites:
|
Opmerkingen:
|
Achtergrondinformatie:
| Enkele formuleringen voor Liesegang ringen zoals ik ze in de literatuur heb gevonden: |
| 1. Koperchromaat
ringen. 4 ml waterglasoplossing (natriumsilicaat, verdund tot een dichtheid van 1.06 g/ml). 0.2 g Kaliumchromaat (K2CrO4) in 4 ml azijnzuuroplossing (ca. 2%). Meng beide oplossingen en giet ze over in een buis. Laat staan tot de gel hard is geworden. Leg 0.5 - 1 g kopersulfaatkristallen op de top. Probeer deze uniform te verdelen. |
| 2.
Kopercarbonaat ringen. Gelijke hoeveelheden waterglasoplossing (natriumsilicaat, verdund tot een dichtheid van 1.06 g/ml) en een 0.25 M ammoniumcarbonaat [(NH4)2CO3] oplossing mengen. Na gellering een 0.25 M oplossing van Cu(NO3)2 of CuCl2 op de gel plaatsen. |
| 3.
Kwikjodide ringen. Gelijke hoeveelheden waterglasoplossing (natriumsilicaat, verdund tot een dichtheid van 1.06 g/ml) en een 0.1 N kaliumjodide (KI) in 1 N azijnzuur oplossing mengen. Na gellering een 0.5 N oplossing van Kwikchloride [HgCl2] op de gel plaatsen. |
| 4. Gelatine experimenten
(Schibici et al). 1.5 g gelatine en 2.5 g chemicalie mengen met 50 ml water en laten reageren. De 2de zout na gelvorming op de top plaatsen: a. In de gel: cobalt(II)chloride Op de top: gec. ammonia b. In de gel: magnesiumchloride Op de top: 19 M NaOH c. In de gel: magnesiumchloride Op de top: gec. ammonia d. In de gel: kopersulfaat Op de top: 0.1 M zilvernitraat e. In de gel: mangaan(II)chloride Op de top: gec. ammonia f. In de gel: uranylnitraat Op de top: gec. ammonia g. In de gel: uranylnitraat Op de top: 19 M NaOH h. In de gel: uranylnitraat Op de top: 0.1 M zilvernitraat i. In de gel: koper(II)chloride Op de top: 19 M NaOH |
| 5.
Loodjodide ringen. Gelijke hoeveelheden waterglasoplossing (natriumsilicaat, verdund tot een dichtheid van 1.06 g/ml) en een 1 N loodacetaat in 0.5 N azijnzuur oplossing mengen. Na gellering een 2 N oplossing van kaliumjodide op de gel plaatsen. |
| 6.
Basisch kwikchloride ringen. Gelijke hoeveelheden waterglasoplossing (natriumsilicaat, verdund tot een dichtheid van 1.08 g/ml) en een 0.5 N azijnzuur oplossing mengen. Na gellering een 0.5 N oplossing van Kwikchloride [HgCl2] op de gel plaatsen. |
| 7.
Calciumfosfaat ringen. Op een 15% gelatine oplossing waaraan ca. 5-20% calciumchloride is toegevoegd wordt na gelleren een 2N Na2H(PO4) oplossing geplaats. |
16/01/2017