

| Corrosie aan een nagel zichtbaar maken |  |
 |
Datum : September 2005
Principe:
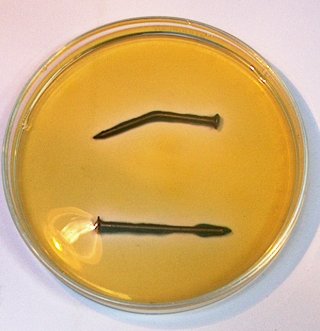
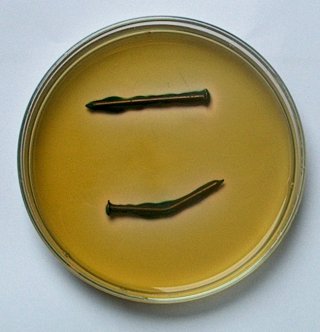
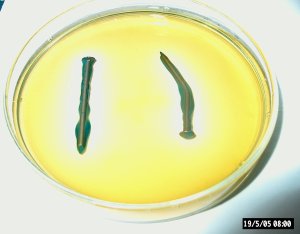
| Door een verbogen nagel in gelatine gedoopt met fenolftaleine en kaliumferricyanide te leggen kunnen we corrosiegebieden zichtbaar maken. |
Benodigd:
|
|
Werkwijze:
|
|
Meetresultaten:
|
|
|
|
Dag 1 |
Dag 2 |
|
|
|
Dag 3 |
Dag 4 |
|
|
|
Dag 5 |
Dag 5 |
Discussie & conclusie:
De corrosie van een metaal is een redox proces.
Als metallisch ijzer oxideert wordt zuurstof gas of waterstof gas gereduceerd
waarbij ferro-ionen en hydroxide ionen of waterstof gas gevormd worden.
Als metalen op de een of andere manier met water in aanraking komen zal dus corrosie plaatsvinden. Op de manier waarop we dit experiment uitgevoerd hebben kunnen we corrosieprocessen zichtbaar maken. Als corrosie plaatsvindt verschijnt er een blauwe kleur bij de anodische gebieden door de reactie van de ferro ionen met het kaliumferricyanide waarbij een diepblauw geleurde verbinding gevormd wordt volgens:
Ondertussen vindt er reductie van zuurstof plaats op de kathodische gebieden van de nagel waarbij de roze kleur van fenolftaleine (zuur-base indikator) aangeeft dat er hydroxide ionen gevormd worden volgens:
Een en ander wordt schematisch weergegeven in onderstaande figuur:
De totale netto corrosie reactie kunnen we schrijven als: Fe(s) + 1/2O2(g) + H2O(l) --> Fe2+(l) + 2OH- (l) |
Opmerkingen:
|
Literatuur:
Relevante websites: Minder relevante websites: |
Achtergrondinformatie:
Bescherming tegen corrosie kan verkregen
wordend door een oppervlak te bedekken met een coating (bv verf). Een betere
bescherming is ook mogelijk door elektrochemische inzichten te gebruiken. Men
dwingt dan een ijzeroppervlak zich als kathode te gedragen en niet als anode
door een elektrochemische cel te creeeren met een lagere halfwaardepotentiaal.
Gegalvaniseerd staal is hiervan een goed voorbeeld. De zink coating gedraagt
zich als anode waardoor het ijzer kathode wordt.
De standaard potentiaal van de cel wordt dan: DE = Eokat - Eoan = (-0.44) - (-0.76) = +0.32V |
18-01-2017
Op 28/2/2006 enkele literatuurreferenties toegevoegd.