

| Synthese van natriumbicarbonaat |
 |
 |
Datum: Juli-Augustus 2010
Principe:
| Een experimentje dat ik in
het verleden al eens geprobeerd heb m.b.v. een zelfgebouwd toestel van
Kipp waarvan de capaciteit echter te klein was. Enige tijd geleden heb
ik via Marktplaats een "kaal" toestel van Kipp gekocht. Het heeft me
ietwat tijd gekost om de ontbrekende onderdelen te verkrijgen maar dat is
me recentelijk gelukt. Om het apparaat in te wijden leek me dit
experiment bijzonder geschikt. Nadat ik het experiment had uitgevoerd begon ik me wat zaken af te vragen. Daarom besloot ik het experiment nogmaals uit te voeren maar nu m.b.v. Coachlab zodat ik het pH en temperatuurverloop kon volgen. |
Materiaal:
|
  |
|
  |
Uitvoering:
| Experiment 1: | |
|
|
| Experiment 2: | |
|
 |
Resultaten:
|
||||||||||||||||||||||||||||
Discussie en conclusie:
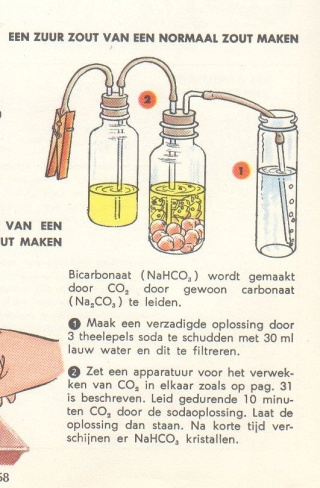
| Zoals ik al vermeld had heb ik
dit experiment al eens eerder proberen uit te voeren m.b.v. een zelfgebouwd
gasproductie toestel (zie nevenstaande figuur). De capaciteit van de
apparaatje m.b.t. de hoeveelheid gas die geproduceerd werd was helaas te
klein. Men moet n.l. wel wat langer doorborrelen dan 10 minuten voordat men
kristalvorming kan waarnemen. Het duurde ca. 1 uur voordat kristalvorming
waarneembaar was. De bruto reactievergelijking die hier van toepassing is: Na2CO3 + H2O + CO2 --> 2 NaHCO3 Na het eerste experiment uitgevoerd te hebben begon ik me echter af te vragen hoe men zeker kan zijn dat men natriumbicarbonaat gemaakt heeft. De eigenschappen zijn verschillend maar ik bedacht me dat het pH verloop gedurende de reactie ook een aanwijzing zou moeten leveren. Om dat idee te controleren heb ik het Coachlab experiment opgezet en uitgevoerd.
|
 |
|||||||||||||||||||||||||||
| In het verleden heb ik me al eens bezig gehouden met CO2 evenwichten in water en pH, hetgeen ik samengevat heb in een Engelstalig document: Carbon dioxide in water equilibrium. | ||||||||||||||||||||||||||||
Het evenwicht waar men in dit document mee
werkt is weergegeven in onderstaande schema:
|
||||||||||||||||||||||||||||
| Op basis van dit schema zouden we onderstaande existentiegebieden kunnen uitrekenen en schetsen voor een concentratie van 1 M. | ||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||
| Dit schema bevestigd min of meer dat we inderdaad natriumbicarbonaat maken als we CO2 door een verzadigde natriumcarbonaat oplossing borrelen. De oplossing wordt dan nl. zuurder en beweegt naar een pH waar het bicarbonaat ion overheerst. Onze observaties m.b.v. Coachlab bevestigen dit. We zakken bijna een volledige pH eenheid gedurende het experiment. De wikipedia pagina's vertellen ons ook dat de oplosbaarheid van natriumbicarbonaat in water (100 g/l) lager is dan die van soda in water (300 g/l), hetgeen mede verklaart waarom deze synthese werkt (herkristallisatie). | ||||||||||||||||||||||||||||
|
Benaderen we dit experiment meer theoretisch. Dan kunnen we op basis van
bovenstaande schema de volgende reacties identificeren:
1) De oplosbaarheid van CO2 in water:
CO2
(g) <=>
CO2 (l) Op basis van deze reactievergelijkingen moet het mogelijk zijn om een vergelijking af te leiden die het mogelijk maakt de pH van de oplossing af te schatten. Definitie: x = [H3O+] and y = [OH-] De protolyseconstanten:
De totale carbonaat concentratie wordt bepaalde door de beginconcentratie c hetgeen het mogelijk maakt de volgende steuchiometrische relatie te definiėren: c = [H2CO3] + [HCO3-] + [CO32-] De water constante: x.y = Kw and pKw =14
De
electroneutraliteitsvergelijking: Uit de evenwichtsconstanten kunnen we afleiden:
Door deze in de steuchiometrische relatie te stoppen kunnen we afleiden:
Substitueren we deze in de electroneutraliteitsvergelijking:
En combineren we bovenstaande met Kw=x.y dan leiden we een 4de graads vergelijking af voor x:
c kunnen we berekenen uit de oplosbaarheid
van soda in water en in combinatie met Excel kunnen we afschatten wat de pH
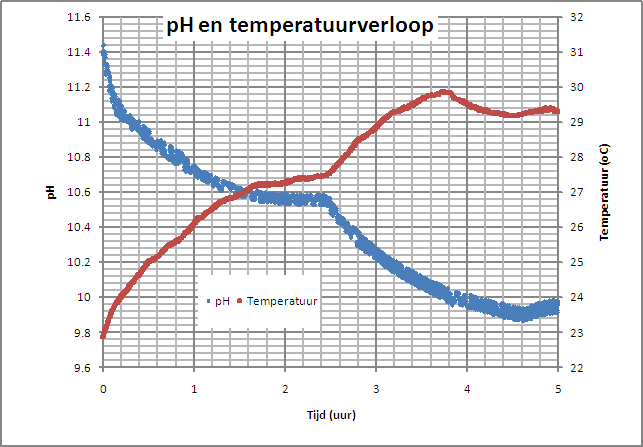
van de "startoplossing" is nl. een pH ~ 12.2. De meetresultaten die we met
Coachlab verzameld hebben zijn weergegeven in onderstaande figuur. |
||||||||||||||||||||||||||||
 |
||||||||||||||||||||||||||||
|
De pH die we in het begin gemeten hebben is iets lager dan de geschatte waarde. Dat is wel verklaarbaar. Het water dat we gebruikt hebben voor de verzadigde soda oplossing was niet CO2 vrij. Waarschijnlijk is er CO2 opgelost hetgeen geresulteerd heeft in een lagere start pH. De knik in de curves rond 2.5 h is het gevolg van het verhogen van de snelheid waarmee CO2 door de oplossing borrelt, |
||||||||||||||||||||||||||||
| Wat mij verbaasde was de temperatuurstijging die we waarnemen zodra we CO2 door de oplossing gaan borrelen. Schijnbaar is het oplossen van CO2 en de daaropvolgende reacties een exotherm proces. Een oppervlakkig literatuuronderzoek bevestigde dat het oplossen van CO2 in water inderdaad een exotherm proces is. Dit is mogelijk ook een verklaring waarom het relatief lang duurt voordat natriumbicarbonaat begint neer te slaan. Door de hogere temperatuur neemt ook het oplosbaarheidproduct van bicarbonaat toe. | ||||||||||||||||||||||||||||
|
Literatuuronderzoek laat ook zien dat deze
methode om natrium bicarbonaat te maken een oude methode is. Volgens van Erp
maakte men de bicarbonaat door soda te laten reageren met het kooldioxide
dat uit minerale bronnen verkregen werd. Onderstaand plaatje laat zien dat
het op het lab op een soortgelijke wijze als in dit experiment beried werd.
Tegenwoordig wordt
natriumbicarbonaat voornamelijk beried via het Solvay proces, waarbij
calcium carbonaat (als bron voor de CO2), natrium chloride,
ammonia en CO2 in water betrokken zijn met als bruto
reactievergelijking: |
||||||||||||||||||||||||||||
Opmerkingen:
|
Literatuur:
Relevante websites:
Minder relevante websites: |
Achtergrondinformatie:
| Het toestel van Kipp Het toestel van Kipp is uitgevonden door de Delftse apotheker Petrus Jacobus Kipp (1808-1864). In 1830 zette hij een zaak op die handelde in wetenschappelijke apparatuur en chemicalien. In 1844 publiceerde Kipp een beschrijving van zijn apparaat in het "Tijdschrift voor Handel and Nijverheid". De oudste bekende kopie van het toestel van Kipp kan men vinden in het Museum Boerhave in Leiden. Dat 62 cm hoge toestel is gemaakt ergens tussen 1845 en 1875. Het toestel van Kipp wordt gebruikt om gas te produceren. Het apparaat is opgebouwd uit drie kamers. De onderste kamer wordt gevuld met zoutzuur (of een ander zuur). Deze kamer staat via een smalle opening in verbinding met de middelste kamer die weer gevuld is met de vaste stof (brokken) die we gebruiken om het gas te maken als het in aanraking komt met zuur. |
 |
| Als we bv CO2willen
maken vullen we de kamer met marmer, willen we waterstof maken dan
vullen we hem met zink. De bovenste kamer die ook een zuur bevat staat
met de onderste kamer in verbinding via een pijp. Als de kraan open
staat zakt het vloeistofniveau in de bovenste kamer waardoor het zich
naar de onderste kamer verplaatst. Hierdoor stijgt het niveau in de
onderste kamer dusdanig dat het naar de middelste kamer gestuwd wordt.
Daar kan het reageren met de daar aanwezige vaste stof. Als de kraan weer wordt dichtgedraaid, zal de druk door de gasontwikkeling in de middelste kamer stijgen. Het zuur wordt daardoor in de onderste kamer geperst, zodat het contact tussen het zuur en de reagerende stof verbroken wordt hetgeen tot gevolg heeft dat de gasontwikkeling stopt. Tegelijkertijd wordt het zuur naar het bovenste reservoir gestuwd. Op deze manier kan het toestel meerdere malen gebruikt worden voor gasproductie. |
|
17-01-2017