

| Oplosbaarheid |  |
 |
Datum: November 2004
Principe:
Oplosbaarheid van polaire en apolaire oplosmiddelen.
Materiaal:
|
|
Uitvoering:
|
Resultaten:
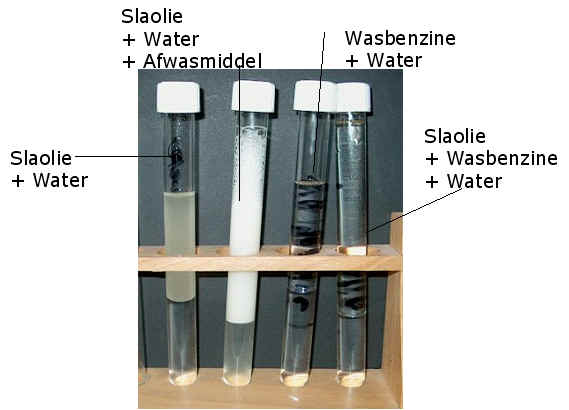 |
Discussie en conclusie:
| Waar we hier mee
te maken hebben is oplosbaarheid. Zoals jullie al thuis ervaren
hebben lossen suiker en keukenzout heel er goed op in water. Zoals we aan
bovenstaand experiment kunnen zien lossen slaolie en wasbenzine niet op in
water maar slaolie weer wel in wasbenzine. Dat een vloeistof niet oplost
in water kunnen we zien als er twee lagen gevormd worden. Stoffen die niet
goed oplossen in water noemen we hydrofobe stoffen terwijl we stoffen die
wel goed in water oplossen hydrofiel noemen.
Vetachtige stoffen bestaan uit moleculen die niet met watermoleculen gemengd kunnen worden. Dat komt doordat watermoleculen elkaar onderling sterker aantrekken dan vet- of oliemoleculen onderling doen. Vetachtige stoffen lossen dus wel op in andere vetachtige stoffen (bv olie's) en in oplosmiddelen zoals benzine, hexaan, terpentine, etc. Als je olie op water schenkt blijft de olie als een aparte laag op het water drijven. Schud je beide vloeistoffen goed door elkaar dan ontstaat een troebel mengsel (een emulsie) die al snel weer schift (weer twee vloeistoflagen vormt) met de olie als bovenste laag. Olie en water mengen dus niet. |
|
| We zien ook dat na het toevoegen van een beetje zeep de situatie veranderd. Er ontstaat een flinke schuimvorming, en een deel van de olie lijkt nu wel in het water op te lossen. In dit geval maken we hier echter een zgn emulsie. Bij een emulsie maken we heel kleine oliedruppels die zich dan verdelen in het water. Het lijkt op oplossen maar is het niet, we praten dan over een vloeistof-vloeistof emulsie. Schuimvorming ontstaat omdat we lucht erdoorheen mengen. We maken dan een gas-vloeistof emulsie. |
|
Opmerkingen:
|
Literatuur:
|
Relevante websites:
Achtergrondinformatie:
|
Oplosbaarheid van enkele stoffen:
Een globale indeling voor oplosbaarheid is:
Oplosbaarheid van stoffen kan be´nvloedt worden door externe factoren zoals de temperatuur. De oplosbaarheid van vaste stoffen is groter bij een hogere temperatuur. Voor gassen geldt echter het tegenovergestelde. Aangezien een hogere temperatuur betekent dat de moleculen sneller bewegen betekent dit dat ze makkelijker uit de oplossing kunnen ontsnappen. Zeepmoleculen bestaan uit een lange koolwaterstofketen aan een eind, die waterafstotend (hydrofoob) is en de andere kant is wateraantrekkend (hydrofiel). In water zullen de zeepmoleculen zich zo rangschikken, dat de waterafstotende delen uit het water steken of tegen een ander oppervlak en de wateraantrekkende delen in het water. Dit heeft tot resultaat, dat de oppervlaktespanning vermindert, want de waterafstotende einden worden afgestoten door de watermoleculen en dus hebben de oppervlaktemoleculen een kleinere aantrekkingskracht naar het centrum van de vloeistof. Door de bovenvermelde eigenschappen van zeep, zal een klein druppeltje vloeibare zeep, dat op een wateroppervlak wordt gelegd, zich zodanig over het oppervlak verspreiden dat een zo dun mogelijke (monomoleculaire) laag ontstaat. Schuim wordt geproduceerd, wanneer een stof,die aan een vloeistof wordt toegevoegd, een duidelijke vermindering van de oppervlaktespanning teweeg brengt. Zuivere stoffen schuimen niet. Het systeem van belletjes dat door zo een combinatie wordt geproduceerd kan gedurende langere tijd behouden blijven en zal slechts in elkaar zakken, tengevolge van externe verstoringen zoals stof, temperatuurveranderingen of trillingen.
|
08-01-2017