

| Potentiometrische titratie van zoutzuur met natronloog |  |
 |
Datum : mei 2003
Principe:
| Het gehalte van zoutzuur (HCl) bepalen d.m.v.
een zuur-base reactie met natronloog. De zuur-base reactie: NaOH + HCl --> H2O + Na+ + Cl- |
Benodigd:
| Zoutzuur
(ca. 8%) Gootsteenontstopper (NaOH, 99%) Bekerglas (100 ml) Gedemineraliseerd water | pH-meter
(in dit geval de Hanna -
Turtle) Spuit (1 ml) Balans |
Werkwijze:
|
|
|
| |
Meetresultaten en resultaten:
|
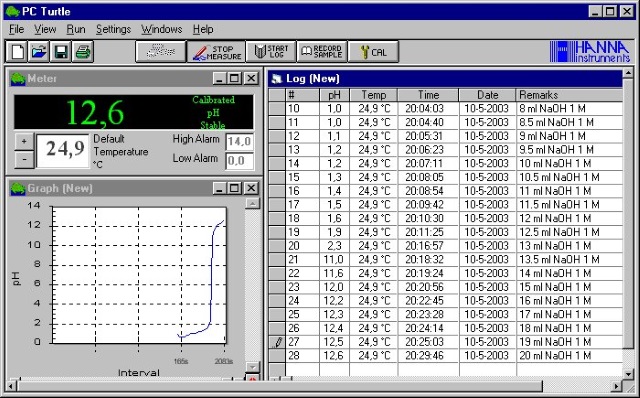
De in dit experiment gebruikte pH meter is aan een computer gekoppeld waardoor we de beschikking hebben over software die het leven iets gemakkelijker maakt. |
|
 |
|
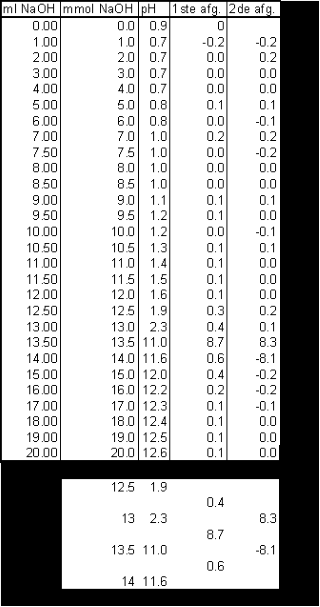
| De meetresultaten kunnen we nu rechtstreeks exporteren als tekstfile en importeren in excel om verder te bewerken en zo onderstaande titratiecurve af te leiden. De concentratie van de NaOH oplossing was 1 M hetgeen betekent dat 1ml NaOH = 1 mmol NaOH (4.0 g NaOH/100 ml = 4/40*1000/100 = 1 mmol/ml). | |
|
|
|
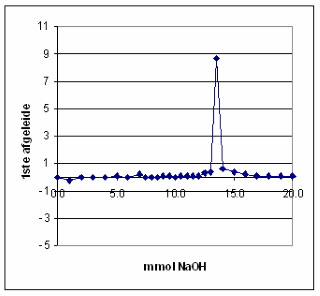
| Het equivalentiepunt vinden we in de titratiecurve terug als een buigpunt. Voor een buigpunt in een curve geldt dat de 1ste afgeleide een maximum moet vertonen, terwijl de 2de afgeleide daar de waarde nul moet hebben. Deze afgeleiden of differentiaalquotiŽnten kunnen worden benaderd door differentiequotiŽnten. Omdat extrapoleren naar een maximum nogal lastig is, bepaalt men ook het tweede differentiequotiŽnt pH", waarvoor geldt: pH"= d2pH/dmmol2=D2pH=Dml2. | |
 |
 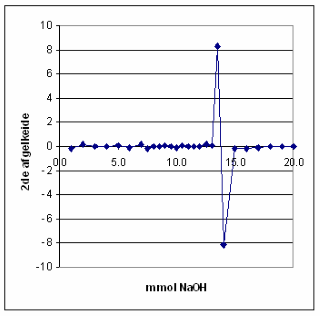 |
|
Het equivalentiepunt ligt dan bij: 13 *
(8.3/(8.1+8.3))*0.5 = 13.253 mmol NaOH We hadden afgewogen: 3.8 g Zoutzuuroplossing. Deze bevat dus 13.253 mmol HCl. 13.253 mmol HCl = 13.253 * 36.5 = 483.7345 mg = 0.483 g HCl / 3.8 g. De zoutzuur concentratie van de oplossing is dan: 12.7 wt% Volgens het etiket op de fles zou de concentratie van het zoutuur < 10% zijn. Een nogal groot verschil dus. |
|
Discussie en conclusie:
| Uiteraard is dit niet een zeer nauwkeurige
analysemethode, de loog is bv niet gesteld, dus de concentratie kan afwijken van
hetgeen we op basis van de wegcijfers verwachten. We weten bv dat loog reageert
met het water en CO2 uit de lucht.
Kunnen we de geneten pH curve afleiden? Gegevens:
Reaktievergelijkingen:
Dit is een titratie van een zeer sterk zuur met een zeer sterke base. Vergelijkingen:Als we HCl oplossen in water dan wordt het volledig gesplitst volgens bovenstaande reactievergelijking. De Cl- ionen reageren niet verder hetgeen betekent dat de chloride concentratie gelijk is aan de zoutzuur concentratie voor we beginnen met titreren. Dus: [Cl-] = c De elektroneutraliteitsvergelijking is het uitgangspunt van de berekeningen. Elke elektrolytoplossing is in haar geheel elektrisch neutraal. De som van alle positieve lading is dus gelijk aan de som van alle negatieve lading. Ionen dragen steeds een geheel aantal elementairladingen en we mogen dus zeggen dat de som van concentraties van de positieve ionen gelijk is aan de som van de concentraties van de negatieve ionen, mits men de concentraties van de meerwaardig geladen ionen met de vereiste factor vermenigvuldigt. De elektroneutraliteitsvergelijking wordt dan: [Cl-] + y = x + [Na+] (1) Onder de
omzettingsgraad l
verstaan we de toegevoegde hoeveelheid reagens in mol gedeeld door de te bepalen
hoeveelheid stof in mol. Voor de titratie van een eenwaardig zuur met een
eenwaardige base ligt het equivalentiepunt dus bij l=1.
Vergelijken
we nu de gemeten waarden met de berekende waarden dan hebben we een aantal
problemen op te lossen. Voor de theoretische benadering is dat iets problematischer. Na afwegen voegen we nl. water toe waardoor de zoutzuur verdund wordt. De makkelijkste manier is nu om op basis van de laagste pH meting de concentratie te berekenen hetgeen betekent dat met pH=0.7 de [HCl]=10-0.7=0.2 M. Deze waarde wijkt echter af van de schatting die we maken. We hebben 13.2 mmol HCl afgewogen en daarna ca. 60 ml water toegevoegd hetgeen zich vertaald naar [HCl]=0.22 M. Uitgaande van de pH meting kunnen we de volgende grafiek berekenen (de berekeningen zijn te bekijken via de excel file):
We zien dat het equivalentiepunt zowel bij theorie en praktijk overeenkomen. We zien echter ook dat na het equivalentiepunt de verschillen tussen de theoretische en de praktische pH waardes en ook de l's groter worden. Deze verschillen worden veroorzaakt door de niet zo nauwkeurige schatting van c, maar ook door de nauwkeurigheid van de pH meter. Deze pH meter is geijkt op maar een calibratiepunt bij pH=7, hetgeen kan beteken dat de meting onnauwkeuriger wordt bij lage zowel als hoge pH. Tevens gaat in het basische gebied de CO2 invloed een rol spelen doordat door de aanwezigheid van CO2 in het water H2CO3 ontstaat.De oplosbaarheid van koolzuur is speciaal in een basisch milieu groot hoewel deze ook in een zure oplossing niet verwaarloosbaar is. Bij deze titratie hebben we niet gebruik gemaakt van koolzuur vrij water hetgeen dus invloed zal uitoefenen op de pH-meting. |
|||||||||||||||
Opmerkingen:
|
Literatuur:
Relevante websites:: |
Achtergrondinformatie:
| POTENTIOMETRIE Onder potentiometrie wordt verstaan het meten
van de bronspanning van galvanische cellen. In de eenvoudigste vorm bestaat een
galvanische cel uit een elektrolytoplossing waarin 2 elektroden zijn geplaatst.
De ene elektode wordt meet- of indicatie-elektrode genoemd en de andere
referentie elektrode. Voor het meten van de bronspanning moet de cel op een
spanningsmeter worden aangesloten. Een probleem hierbij is dat dan niet de
bronspanning (Vb = Vox - Vred) maar de klemspanning (Vk) gemeten wordt. M.b.v de wet van Ohm
kunnen we echter het verband tussen bron- en klemspanning afleiden:
NATRONLOOG Natriumhydroxide NaOH. Komt in de handel voor als witte brokken, pijpjes, pastilles en schilfers. Zeer goed oplosbaar in water onder aanzienlijke temperatuurverhoging. Hygroscopisch, vervloeit aan de lucht, trekt tevens CO2 aand, vorming van Na2CO3. Natronloog tast glas aan, onder vorming van natriumsilicaat. Het voelt vettig aan en tast de huid sterk aan. Bereiding:
Toepassingen:
ZOUTZUUR HCl. Geconcentreerde oplossing van HCl-gas in water. s.m. 1.19; 37 gewichts%, 12 n. Kleurloze vloeistof, ruw zoutzuur in geel gekleurd door sporen door sporen FeCl3, vormt aan vochtige lucht nevens, met ammoniakdamp geeft het een witte nevel van NH4Cl. Zoutzuur is een sterk zuur waardoor de meeste metalen worden aangetast. Bereiding:
ZUUR-BASE-REACTIES Lange tijd heeft men de door Arrhenius (1887) geformuleerde indeling van elektrolyten in zuren, basen en zouten gebruikt:
In de praktijk bleek deze definitie echter niet te voldoen. Voor een beter definitie van zuren, basen en zouten zorgde Brfnsted (1923), die de definities van zuren en basen baseerde op het volgende reactieschema: zuur <=> base + proton (H+-ion) Onder zuren worden stoffen verstaan die protonen kunnen afsplitsen en met basen stoffen die protonen kunnen opnemen. Een verzamelnaam voor zuren en basen is protolyten. Zouten zijn neutrale stoffen die zich in waterige oplossing in ionen splitsen, die zich al of niet als protolyten kunnen gedragen. Kijken we nu naar zoutzuur: HCl --> H+ +
Cl- Sommige stoffen kunnen zich zowel basisch als
zuur gedragen, de amfolyten:
Hetgeen we voor water hebben gedaan kunnen we ook voor zuren en basen doen:
Om nu pH berekeningen te kunnen maken zijn maar een paar vergelijkingen noodzakelijk:
Door deze vergelijkingen uit te schrijven krijgen we evenveel vergelijkingen als onbekenden. |
12-01-2017