

| Permanganaat fontein |
 |
 |
Datum: Juli 2006
Principe:
| In een kleurloze oxaalzuuroplossing wordt het paarse permanganaat gereduceerd. |
Materiaal:
|
Uitvoering:
|
Meetresultaten:
|
|
 |
 |
 |
|
 |
||
|
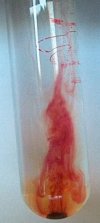
Bij het afzinken van het
kristal kan men een violet spoor waarnemen dat snel verdwijnt. |
|||||||
|
|
 |
 |
 |
|
 |
||
|
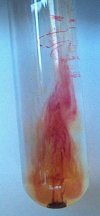
Het lijkt alsof zich een
violette fontein in de reageerbuis gevormd heeft. |
|||||||
 |
 |
 |
 |
 |
 |
||
|
Laat men de oplossing staan totdat alle permanganaat is weggereageerd dan blijft er een heldere oplossing achter (geen foto van toegevoegd). |
|||||||
Discussie en conclusie:
In deze reactie wordt oxaalzuur gereduceerd tot
CO2 en het permanganaat gereduceerd tot Mn2+ volgens:
Het permanganaat ion haalt elektronen van de oxaalzuur moleculen en oxideert daardoor het oxaalzuur. Het MnO4- ion gedraagt zich als een oxidator in deze reactie terwijl oxaalzuur de reductor is in deze reactie. Door elektronen over te dragen reduceert het het MnO4- ion tot Mn2+. De overall reactie is dan: 2 MnO4-(aq ) + 5 H2C2O4(aq ) + 6 H3O+(aq ) --> 2Mn2+(aq ) + 10 CO2(aq ) + 14 H2O Deze reactie is echter ook een voorbeeld van autokatalyse, de Mn2+ ionen die gevormd worden katalyseren de reactie waardoor de reactiesnelheid toeneemt. Mn2+ ionen zijn echter kleurloos. De bruine kleur die na verloop van tijd gevormd wordt heeft dus een andere oorzaak. Typerend is dat de reactie van permanganaat met weliswaar vaak in de literatuur beschreven wordt maar dat deze dan altijd eindigt in een kleurloze oplossing. De vraag is dus welke reactie hier plaatsvindt. Zetten we alle oxidatietoestanden van mangaan op een rij:
In feite is de bruine kleur dus een aanwijzing dat er Mn4+ ionen gevormd worden. MnO2, bruinsteen is ook bruinkleurig. De vorming van Mn4+ wordt in de literatuur niet beschreven. Een probleem blijft ook dat alhoewel de vorming van een bruine kleur impliceert dat er bruinsteenvorming plaatsvindt we geen neerslagvorming kunnen waarnemen. Een probleem dat we hebben dat vorming van bruinsteen uit permanganaat plaatsvindt in alkalische milieu, in zuur milieu (zoals hier) vindt de vorming van Mn2+ plaats. Reactie: MnO4- + 2 H2O + 3e --> MnO2 + 4 OH- Dat de oplossing zuur blijft gedurende het hele proces dat hierboven te zien is heb ik met pH papiertjes nog eens gecontroleerd (pH ~1). Volgens de literatuur gebruikt kan men Mn(II) bepalen mbv de Volhard Mn methode waarin de Mn2+ kwantitatief geconverteerd wordt naar MnO2 volgens: 3 Mn2+ + 2 MnO4- + 6 H2O --> 5 MnO2 + 4 H3O+ Het probleem is dat volgens de beschrijving deze reactie in nagenoeg neutraal milieu laat plaatsvinden, in aanwezigheid van een overmaat ZnO om het zuur dat gevormd wordt weg te laten reageren. MnO2 kan nl zowel in zuur als in basisch milieu verder reageren, bv volgens: MnO2 + 2 OH- --> MnO32- + H2O MnO2 + 4 H3O+ --> Mn2+ + 6 H2O Desalniettemin denk ik dat de kans groot is dat inderdaad bovenstaande (Volhard) bruinsteenvormingsreactie plaatsvindt. In een titratie hebben we als primaire doelstelling om alles 100 % kwantitatief te laten verlopen, vandaar dat we ons uiterste best doen om de oplossing neutraal te houden. In ons geval hoeft de vorming van bruinsteen echter niet kwantitief te zijn. Zelfs als het maar gedeeltelijk plaatsvindt zouden we hiermee de bruine kleur kunnen verklaren. Dat we geen neerslag van bruinsteen kunnen waarnemen is misschien een indicatie dat collo´dale deeltjes gevormd worden waarbij deze collo´dvorming misschien een reden is voor de stabilisatie van deze bruinsteendeeltjes. Daarnaast kan de vormingsreactie van bruinsteen sneller verlopen dan de ontledingsreactie hetgeen waarschijnlijk is omdat men uiteindelijk inderdaad een heldere oplossing overhoudt. Kalbus et al zijn ook van mening dat bruinsteen gevormd wordt volgens de Volhard reactie maar koppelen dit aan een tekort aan zwavelzuur. De pH metingen lijken dit echter tegen te spreken. Dit alles is speculatie maar het zou interessant zijn om te onderzoeken of bruinsteen inderdaad gevormd wordt. Misschien is het mogelijk om de reactie te bevriezen door het zuur te neutraliseren als de bruine kleur aanwezig is. |
Opmerkingen:
|
Literatuur:
|
16-01-2017