

| Elektrochemische metaalbewerking |  |
 |
Datum : september 2002
Principe:
| Door middel van een elektrolysereactie een klein gaatje maken in een scheermesje. |
Benodigd:
| Zoutzuur Scheermesje Potlood | Gelijkspanningsbron (13.8 V 5A - mag waarschijnlijk ook een batterij zijn) |
Werkwijze:
|
|
|
Meetresultaten:
| Na enkele minuten is er een klein gat in het scheermesje ontstaan. |
 |
 |
| Het scheermesje voor de bewerking. | Het scheermesje na de bewerking met een gaatje tussen de G en de i. |
|
|
Tijdens het bewerken kan men schuimvorming waarnemen hetgeen wijst op gasontwikkeling. |
 |
Bekijken we na bewerking (na enkele dagen) de punt iets nauwkeuriger (60x vergroot) dan kunnen we zien dat er ijzeroxide gevormd is op de punt. |
Discussie en conclusie:
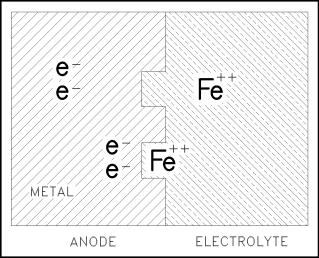 |
In feite maken we hier gebruik van een vorm van corrosie.
In nevenstaande figuur wordt de ladingsoverdracht weergegeven als ijzer in contact gebracht wordt met water of een aangezuurde waterige oplossing. IJzer gaat in oplossing als Fe2+, het gevolg daarvan is dat het metaal negatief geladen wordt (de elektronen blijven achter) t.o.v. het elektrolyt. Het gevolg is dat er een potentiaalverschil gecreŽerd wordt tussen het elektrolyt en het metaal. Er vindt oxidatie plaats. |
|
|
Plaatsen we nu spanning ober het geheel dan worden de positieve ijzerionen naar de - van de potloodpunt getrokken. We creŽren een extra drijvende kracht door een potentiaalverschil aan te leggen. Het gevolg daarvan is dat het ijzer sneller in oplossing gaat. |
|
Elektrolyse wordt toegepast om subtiele bewerkingen aan metaaloppervlakken uit te voeren, volgens het principe dat hierboven geschetst is. 13/6/2005: De observaties van hierboven nog even samengevat: Ik heb de potloodpunt pas na enkele dagen
bekeken onder de microscoop en toen gezien dat er ijzeroxide gevormd was. De reactie die (volgens mij) plaats vindt
is die van een metaal met zuur: je lost ijzer op onder vorming van waterstof. Voor ijzer verloopt de oxidatie volgens: 4Fe +
3O2 --> 4Fe3+ + 6O2- (= 2Fe2O3
= roest) Als je het als een zuivere redox reactie wilt
gaan schrijven uitgaande van Fe2+: Deze reactie kun je ook schrijven als: |
|
Opmerkingen:
|
Literatuur:
Relevante websites:: |
Achtergrondinformatie:
| Fe -> Fe2+ | E0 = -0.44 V |
16-01-2017