

| Schoon geld |
 |
 |
Datum: augustus 2002
Principe:
Zuur en zout gebruiken voor het schoonmaken van koperen muntjes.
Materiaal:
|
Azijnzuur |
Citroenzuur |
|
|
Uitvoering:
|
Citroenzuur |
|
|
|
|
|
Azijnzuur |
|

|
|
Resultaat:
|
Citroenzuur |
|
 |
Vergelijken we de behandelde munten met de niet-behandelde munten dan zien we dat deze veel schoner zijn geworden. Het doffe laagje is verwijderd. |
|
Azijnzuur |
|
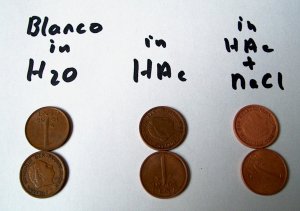 |
Vergelijken we de behandelde munten met de niet-behandelde munten dan zien we dat deze veel schoner zijn geworden. Het doffe laagje is verwijderd. Op de foto is dit echter niet goed te zien. Er is wel goed te zien dat het toevoegen van zout de munten beter schoonmaakt. De effect manifesteert zich al in de eerste minuut. |
Discussie en conclusie:
Vatten we de observaties samen:
De zuurstof in de lucht reageert met het koper in de munt onder de vorming van koperoxide (CuO) aan de buitenkant van de munt. Dit koperoxide heeft een donkere kleur, vandaar dat de munt donkerder wordt in de loop van de tijd. Reaktievergelijking: 2Cu + O2 -> 2CuO Het zuur van de citroen, het citroenzuur, verwijderd het laagje koperoxide van de munt waardoor deze weer gaat glanzen. De 'globale' reactie van het oplossen van het koperoxide in citroenzuur (of azijnzuur) luidt: H3C6H5O7 + 3H2O -> C6H5O73- + 3H3O+ 2H3O+ + CuO -> Cu2+ + 3H2O Blijven we met de vraag zitten waarom het toevoegen van zout een versnellend effect heeft. De literatuur(3) geeft daarover uitsluitsel. Chloride ionen hebben een co÷rdinerend vermogen. Voor Cu2+ geldt : Voor Cu+ geldt: Cu+ komt echter normaliter niet voor
in water aangezien: Complexvormingsreacties be´nvloeden dit evenwicht echter. En men kan uitrekenen dat Cu+ inderdaad in de oplossing aanwezig is. Dat betekent in feite dat naast de reaktie met zuur er een andere complexvormingsreactie aan het koperoxide zit te 'trekken', waardoor het sneller oplost. De snelste manier om deze theorie te controleren is door het experiment te herhalen met zoutzuur, doen we dat (zie onderstaande foto) dan zien we dat ook met zoutzuur de koperen munten onmiddellijk helderder worden, hetgeen dus bovenstaande verklaring ondersteund.
|
Opmerkingen:
|
Literatuur:
|
Relevante websites: |
17/01/2017