

| Identificatie van metalen mbv de vlamproef |
 |
 |
Datum: November 2004
Principe:
| Gekleurde vlammen maken door een verbinding in contact te brengen met een kleurloze vlam. |
Materiaal:
|
|
Uitvoering.
|
|
 |
Resultaat:
|
|
|
| natriumchloride in water - geel | kopersulfaat in water (verz.) - lichtgroen |
 |
 t t |
| calciumcarbonaat in HCl - groen | calciumchloride in water - rood |
 |
 |
| zinkchloride in water - groenig | bariumhydroxide in HCl - geel-groen |
 |
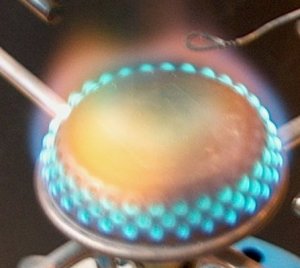 |
| strontiumchloride in water - rood | tinchloride in water - geelgroenblauw(?) |
 |
 |
| kaliumchloride in water - paars | paarsfilter |
|
Indien men oplossingen onderzoekt weet men van tevoren niet of er kalium in zit. Er is echter wel nagenoeg altijd natrium aanwezig en de gele kleur van natrium is zo sterk dat men het paars niet meer kan zien. We bekijken dan de vlam met een paarsfilter (een paars gekleurd stukje glas) die het geel wegfiltert en de paarse kleur juist zichtbaar maakt. |
|
 |
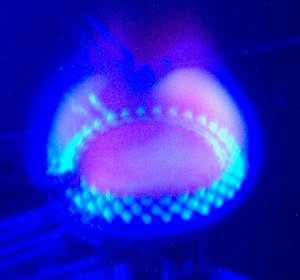 |
| paarsfilter zonder KCl | paarsfilter met KCl |
Discussie:
|
Bij het uitgloeien van de draad zien we dat de vlam een gele kleur krijgt. Dit is kleuring die veroorzaakt door natrium. Bijna alle spullen om ons heen hebben wel wat natrium op zich, vaak in de vorm van NaCl. Vandaar dat we eerst moeten uitgloeien. Men lost de verbindingen bij voorkeur op in een sterke zoutzuuroplossing om er op zijn minst gedeeltelijk een chloride van te maken waarvan men mag aannemen dat die voldoende vluchtig is. Dit laatste is van belang indien men een onbekende stof wilt onderzoeken. In ons geval kunnen we ook direct chlorides testen. Voor de verklaring van deze observaties kunnen we gebruik maken van een eenvoudig atoommodel. Een atoom is opgebouwd uit een kern waaromheen elektronen draaien in banen. Door verhitting voegen we energie toe aan het systeem en springen de elektronen naar een hogere baan. Indien een elektron nu terugvalt naar een lagere ban zendt het licht uit van een bepaalde golflengte. Voor elk element krijgen we op deze manier een uniek lijnen- en banden spectrum. Indien dit spectrum binnen het zichtbare deel van het spectrum valt kunnen we het als vlamkleuring waarnemen. |
Conclusie:
|
Opmerkingen:
|
Literatuur:
Relevante Websites: Minder relevante websites: |
Achtergrondinformatie:
| Vlamkleuringen |
| Stof | Kleur | Stof | Kleur |
| Natrium | geel | Thallium | helder groen |
| Kalium | zwak violet | Koper (oxides) | smaragdgroen |
| Rubidium | zwak violet | Fosforzuur | zwak geel-groen |
| Cesium | zwak violet | Salpeterzuur | brons-groen |
| Lithium | wijnrood | Zinkmetaal | zwak blauw-groen |
| Strontium | wijnrood | Koperhalogeniden | azuurblauw |
| Calciumfluoride | helder rood | Indium | baluw-violet |
| Calcium | steenrood | Lood | zwak blauw |
| Barium | geel-groen | Seleen | helder blauw |
| Molybdeen | geel-groen | Arseen | zwak blauw-grijs |
| Telluur | zwak groen | Antimoon | zwak blauw-grijs |
| Borium | helder groen | Bismuth | zwak blauw-grijs |
| Vlamemissiefotometrie Op het principe van de vlamkleuring is ook een
kwantitatieve bepalingsmethode gebaseerd, de vlamemissiefotometrie. Zoals
hierboven reeds verteld. Als men aan moleculen thermische energie toevoert
vallen deze uit elkaar in vrije atomen. Door energieopname komen de atomen nu in
een aangeslagen toestand terecht waarna de opgenomen energie afgestaan wordt
onder uitzending van straling. De straling die uitgezonden wordt is opgebouwd
uit karakteristieke golflengtes: het emissiespectrum bestaat uit een aantal
discrete energieniveaus, een zgn. lijnenspectrum (bij een natriumverbinding
wordt bijna alleen maar licht met golflengtes van 589.0 en 589.6 nm uitgezonden
- de Natrium D lijn). Schema vlamemissiespectrometer: |
12-01-2017