

| Zoutzuur bereiding |  |
 |
Datum: februari 2003
Principe:
Een zoutzuuroplossing maken en de sterkte ervan bepalen.
Materiaal:
|
|
Uitvoering:
Zoutzuurbereiding
|
|
Titratie
|
|
Resultaten:
|
Bereiding: Weegcijfers: NaCl: 3.6 g NaHSO4.H2O = 3.5 g |
|
|
|
Titratie: Weegcijfers loog: 1 g NaOH/50 ml H2O Weegcijfer monster: 20.6 g Titratie ml loog: 7 ml |
||
Observaties bereiding:
|
Discussie en conclusie:
| De zoutzuur
bereidingsreactie:
NaCl + NaHSO4 --DT-->
Na2SO4 + HCl (g) |
De titratie
(neutralisatie) reactie: H3O+ + Na+ + OH- + Cl- --> Na+ + Cl- + H2O NaOH (sterke base) splitst in water volledig in ionen: NaOH --> Na+ + OH- HCl (sterk zuur) reageert kwantitatief met water: HCl + H2O --> H3O+ + Cl- Bij menging van de twee oplossingen krijgen we de neutralisatie reactie: H3O+ + OH- --> 2 H2O |
| De molmassa van NaOH = 40
g/mol 1 g NaOH per 50 ml = 1/40/50 *1000 = 0.5 mmol/ml Dus de sterkte van de loog oplossing: 0.5 M (mol/l) We hebben 20.6 g monster afgewogen. We hebben 7 ml loog nodig gehad om het omslagpunt te bereiken. in 20.6 g monster zitten dan: 7 * 0.5 = 3.5 mmol zuur. De molmassa van zoutzuur = 36.5 g/mol (mg/mmol) Dus in 20.2 6 vloeistof zitten 3.5 * 36.5 = 127 mg = 0.127 g zoutzuur De zoutzuurconcentratie is dus 0.127 g/20.6 g * 100 = 0.6 % |
Voor zoutzuur geldt: HCl + H2O <=> H3O+ + Cl- Berekenen we nu de pH van de oplossing. Waarbij we weten dat het evenwicht volledig naar rechts ligt: 0.6% = 6 g HCl/l = 6/36.5 mol/l = 0.16 M pH = - log [H3O+] = - log 0.16 = 0.8 |
|
Zuur-base titratie |
|
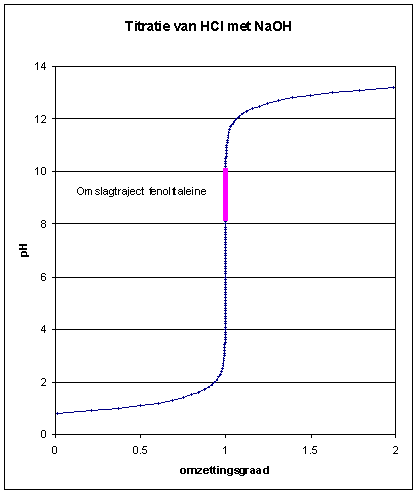
| Hetgeen we uitgevoerd hebben
is een zuur-base titratie waarbij we het zuur titreren met loog volgens de
neutralisatiereactie hierboven geschetst. We hebben voldoende informatie
om de titratiecurve af te leiden. We maken hier gebruik van de
omzettingsgraad l.
Onder de omzettingsgraad wordt verstaan de hoeveelheid reagens in mol
gedeeld door de te bepalen hoeveelheid stof, ook uitgedrukt in mol. We
hebben hier te maken met de titratie van een zeer sterk zuur (concentratie
c) dat getitreerd wordt met een zeer sterke base.
elektroneutraliteitsvergelijking: [Na+] + x = y + [Cl-] De [Cl-] is bij het begin van de titratie gelijk aan c, bij gelijkblijvend volume blijft deze concentratie gelijk gedurende de titratie. De [Na+] is gekoppeld aan de l volgens: [Na+]=cl Dus: cl
+ x = y + c hetgeen herschreven kan worden als: De startconcentratie van HCl: c = 0.16 M Met gebruik van excel kunnen we nu gemakkelijk een titratiecurve afleiden. |
 |
Opmerkingen:
|
Literatuur:
Relevante websites: |
Achtergrondinformatie:
| ZOUTZUUR HCl. Geconcentreerde oplossing van HCl-gas in water. s.m. 1.19; 37 gewichts%, 12 n. Kleurloze vloeistof, ruw zoutzuur in geel gekleurd door sporen door sporen FeCl3, vormt aan vochtige lucht nevens, met ammoniakdamp geeft het een witte nevel van NH4Cl. Zoutzuur is een sterk zuur waardoor de meeste metalen worden aangetast. Bereiding:
ZUUR-BASE-REACTIES Lange tijd heeft men de door Arrhenius (1887) geformuleerde indeling van elektrolyten in zuren, basen en zouten gebruikt:
In de praktijk bleek deze definitie echter niet te voldoen. Voor een beter definitie van zuren, basen en zouten zorgde Brfnsted (1923), die de definities van zuren en basen baseerde op het volgende reactieschema: zuur <=> base + proton (H+-ion) Onder zuren worden stoffen verstaan die protonen kunnen afsplitsen en met basen stoffen die protonen kunnen opnemen. Een verzamelnaam voor zuren en basen is protolyten. Zouten zijn neutrale stoffen die zich in waterige oplossing in ionen splitsen, die zich al of niet als protolyten kunnen gedragen. Kijken we nu naar zoutzuur: HCl --> H+ +
Cl- Sommige stoffen kunnen zich zowel basisch als
zuur gedragen, de amfolyten:
Voor deze evenwichtbeschrijvingen maakt me gebruik van log beschrijvingen.
Hetgeen we voor water hebben gedaan kunnen we ook voor zuren en basen doen:
Om nu pH berekeningen te kunnen maken zijn maar een paar vergelijkingen noodzakelijk:
Door deze vergelijkingen uit te schrijven krijgen we evenveel vergelijkingen als onbekenden. De pH van verschillende oplossingen:
|
18-01-2017