Absorptiespectrometrie


|
Absorptiespectrometrie |

|

|
In de colorimetrie wordt de concentratie van een gekleurde stof bepaald door de kleur dan de oplossing van die stof te vergelijken met oplossingen waarin diezelfde gekleurde stof zit maar dan in concentraties die bekend zijn. De kleur kan afkomstig zijn van de stof zelf maar kan ook het reactieproduct zijn van de te meten stof met een geschikt reagens.
Een voorbeeld is het dieprode complex dat gevormd wordt als een overmaat thiocyanaat aan een Fe(III) ionen toegevoegd wordt:
Fe3+ + 6SCN- <=> Fe(SCN)63-
Vroeger werden dit type metingen visueel uitgevoerd (in Nessler buizen). Tegenwoordig maakt men gebruik van een instrument, de absorptiespectrometer (nauwkeuriger).
Licht is een elektromagnetisch golfverschijnsel dat zich met een constante snelheid (c) van ca. 3 x 10-8 m/s voortplant.
Een golf kunnen we karakteriseren met:
Aangezien de golfsnelheid: c = (afgelegde
weg / tijd) = l
/ T = f . l
(f=1/T).
Hetgeen betekent dat als de golflengte toeneemt de frequentie afneemt en vice
versa.
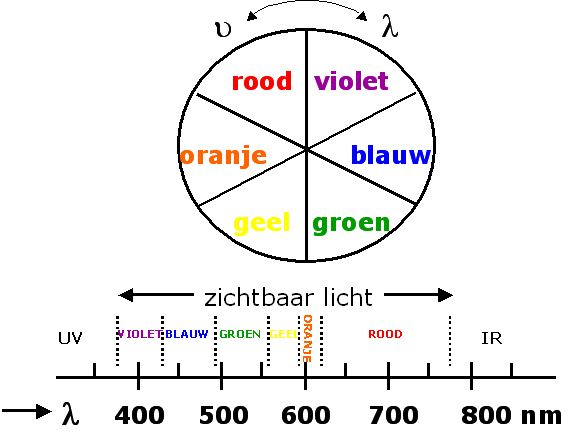
De zichtbare straling (het witte licht spectrum) beslaat slechts een klein deel het totale spectrum en bevat alle golflengtes tussen 400 en 800 nm en wordt daarom polychromatisch (veelkleurig) genoemd. Bij splitsing van wit licht door bv een prisma ontstaat een volledig regenboogspectrum. Het is nu gebruikelijk om zichtbare straling in een bepaald golflengtegebied aan te duiden als monochromatisch (eenkleurig/enkelvoudig) licht.
Kleurenspectrum
| golflengte (nm) | kleurindruk |
| 380 - 435 | violet |
| 435 - 495 | blauw |
| 495 - 565 | groen |
| 565 - 590 | geel |
| 590 - 625 | oranje |
| 625 - 780 | rood |
Als we uit wit licht nu de kleur groen verwijderen dan blijft als kleur een mengsel van rood, oranje, geel, blauw en violet licht over dat voor het menselijk oog de indruk van rood licht geeft. Twee kleuren licht die door samenwerking wit licht teweeg brengen worden complementair genoemd. Deze kleuren staan in de zgn kleurencirkel tegenover elkaar (zoal bv rood en groen). Dit betekent dat een voorwerp dat van het opvallende licht het groene licht absorbeert en de overige kleuren licht vrijwel geheel terugkaatst als rood waargenomen wordt.
Een gekleurde oplossing absorbeert dus uit de doorvallende straling het licht met de complementaire kleur het sterkst.
Kleurencirkel en kleurenspectrum
De energie die een stof bij verhitting heeft opgenomen kan in de vorm van straling worden afgestaan (emissie), het principe van een lamp. De geŽmitteerde straling kan door oplossingen, vloeistoffen, gassen en doorzichtige vaste stoffen voor een deel worden geabsorbeerd, terwijl het restant van de ontvangen straling in de oorspronkelijke voortplantingsrichting wordt doorgelaten (getransmiteerd).
Voor het meten van de mate van transmissie (en dus indirect de absorptie) wordt een cuvet (een vaatje van glas, plastic of kwarts met parallele wanden) met de vloeistof gevuld. Door de cuvet wordt monochromatisch licht gestuurd. Achter de cuvet wordt de intensiteit van het doorgelaten licht gemeten. Door nu de golflengte van de monochromatische stralingsbron te variŽren kan de mate van transmissie (en absorptie) over het gehele zichtbare stralingsgebied bepaald worden en bepalen we dus in feite het absorptiespectrum.
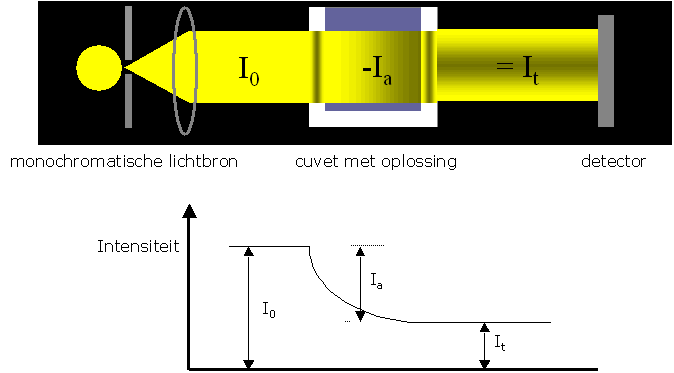
De doorgelaten lichtbundel (It) is zwakker dan de opvallende lichtbundel (Io) door:
Voor de meting is alleen de absorptie veroorzaakt door de opgeloste stof van belang. Om voor de invloed van de andere factoren (vooral 1,2,4) te corrigeren meten we eerst een blanco (een zoveel mogelijk identieke cuvet gevuld met reagentia en oplosmiddel maar zonder de te meten stof). De intensiteit van de blanco trekken we dan van de meetoplossingen af.
We mogen dan schrijven: Io = Ia + It
De hoeveelheid licht die een oplossing doorlaat (transmitteert) wordt uitgedrukt in de grootheid transmissie (T). Onder de transmissie (T) wordt verstaan het quotiŽnt - eventueel uitgedrukt in procenten - van de doorgelaten hoeveelheid licht (It) en de opvallende hoeveelheid licht (Io):
Transmissie: T = It/Io ( * 100 = %T)
Absorptie: A = 1-T = Ia/Io
In de absorptiespectrometrie wortd, in plaats van met transmissie of met absorptie, met de grootheid extinctie (E, uitdoving) gewerkt (de negatieve logaritme van de transmissie).
In het bovenstaande verhaal hebben we de weglengte buiten beschouwing gelaten. De transmissie is echter ook afhankelijk van de lengte (l) die het licht doorloopt.
Lambert vond de volgende betrekking voor
homogene media en monochromatisch licht:
Door een eenheidslaag van een bepaald medium wordt steeds hetzelfde percentage
dan het opvallende licht doorgelaten (oftwel: It/Io = a met a <1).
Hieruit volgt dat indien de laagdikte (l) rekenkundig toeneemt, het doorgelaten
licht (It) afzwakt volgens een meetkundige reeks.
Beer heeft een soortgelijke relatie gevonden
voor een homogene oplossing en monochromatisch licht maar nu voor de
concentratie:
Indien de concentratie (c) rekenkundig toeneemt, neemt It af volgens een
meetkundige reeks (It=Io.a')
We kunnen deze relaties ook formeler afleiden:
De wet van Lambert:
Wanneer licht met een intensiteit Io op een oneindig kleine dl van een
absorberend medium valt, dan is de intensiteitafname dI evenredig met I en dI
(k is een evenredigheidsconstante).
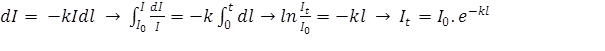
Analoog kunnen we voor de wet van Beer afleiden dat:
![]()
Combineren we beide en converteren we de formule van natuurlijke logaritmes naar Briggse logaritmen:
![]()
De algemene wet van Lambert-Beer wordt dan:
![]()
e wordt de extinctiecoŽfficiŽnt genoemd. Wanneer c in mol/l en l in cm uitgedrukt wordt spreken we van de molaire extinctiecoŽfficiŽnt. e is constant voor een bepaalde stof en ook afhankelijk van het oplosmiddel, de temperatuur en de golflengte. Hoe groter e des te gevoeliger de meting .
De wet van Lambert-Beer geldt alleen als aan de volgende voorwaarden wordt voldaan:
In de literatuur over spectrometrie bestaan ook nog andere concentratie aanduidingen en het is gebruikelijk voor een duidelijk onderscheid de benaming en het symbool van de extinctiecoŽfficiŽnt aan te passen aan de gebruikte concentratie aanduiding.
Namen en symbolen voor K, afhankelijk van concentratie aanduiding
| concentratie uitgedrukt in | formule | extinctiecoŽfficiŽnt K aangeduid met benaming | extinctiecoŽfficiŽnt K aangeduid met symbool |
| mol/l | E = e . l . c | molaire extinctiecoŽfficiŽnt | e |
| gram/ml | E = Es . l . c | specifiek extinctiecoŽfficiŽnt | Es |
| gram/100 g (ml) | E
= |
extinctie ťťn %, ťťn centimeter |
|
Een spectrometer die gebruikt wordt voor deze metingen benvat een aantal basisonderdelen die schematisch weergegeven zijn in onderstaande figuur.
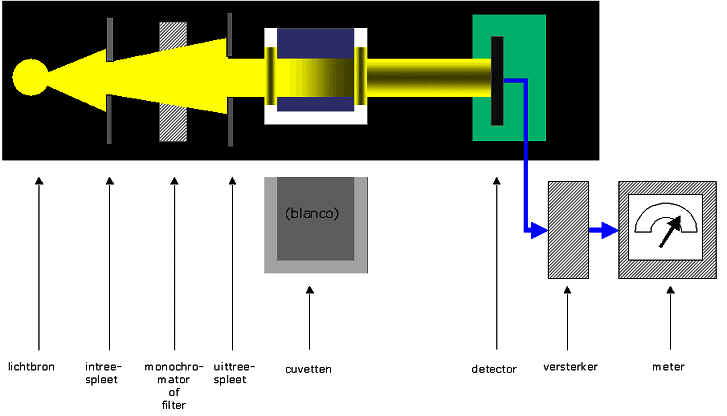
Er heerst een grote verwarring in de benamingen en de symbolen in de absorptiespectrometrie.
Onderstaande tabel geeft een overzicht.
Benamingen en symbolen in de absorptiespectrometrie
| symbool | Nederlands | Frans | Duits | Engels/Amerikaans | symbolen |
| I0 | intensiteit van het invallende licht | intensitť incidente | Intensitšt des eintretenden Lichtes | icident intensity; incident radiant power | I0,P0 |
| I | intensiteit van het doorgelaten licht | intensitť transmise | Intensitšt des austretenden Lichtes | transmitted intensity; transmitted radiant power | I,P |
| T | transmissie; doorlating | transmission; (transparence) | Transmission; Durchlšssigkeit | Transmittance; Transmittancy | T.Ts, (D) |
| E | extinctie; (optische dichtheid) | absorbance; (densitť optique) | Extinktion; (optische Dichte) | absorbance (Am.); absorbancy; optical density (Eng.); extinction | E,A,As, (O.D.) |
| K | extinctiecoŽfficiŽnt | coefficient d'absorption | Extinktionscoeffizient | extinction coefficient; absorption coefficient; (absorbance index); absorptivity (Am.) | K,a,as, (k) |
| e | moleculaire extinctiecoŽfficiŽnt | coefficient d'absorption molťculaire; coefficient d'absorption spťcifique | mol(ekul)are Extinktionscoeffizient | molar extinction coefficient; (molar absornancy index); molar absorptivity (Am) | e,am |
| c | concentratie | concentration | Konzentration | concentration | c |
| l | laagdikte; optische weglengte | ťpaisseur longeur | Schichtdicke | thickness, optical path length | l,d,b |
| M | molecuulmassa | poids molťculaire | Molekulargewicht | molecular weight | M,m |
|
|
|
23-03-2013