pH en zuurgraad


|
pH en zuurgraad |

|

|
|
Theorie Lange tijd heeft men de door Arrhenius (1887) geformuleerde indeling van elektrolyten in zuren, basen en zouten gebruikt:
In de praktijk bleek deze definitie echter niet te voldoen. Voor een beter definitie van zuren, basen en zouten zorgde Bronsted (1923), die de definities van zuren en basen baseerde op het volgende reactieschema: zuur <=> base + proton (H+-ion) Onder zuren worden stoffen verstaan die protonen kunnen afsplitsen en met basen stoffen die protonen kunnen opnemen. Een verzamelnaam voor zuren en basen is protolyten. Zouten zijn neutrale stoffen die zich in waterige oplossing in ionen splitsen, die zich al of niet als protolyten kunnen gedragen.
|
|
|---|---|---|
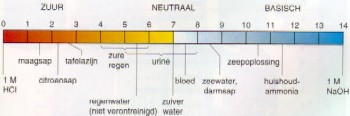
| pH van diverse oplossingen | ||
|
Oplossing |
pH |
|
| Zoutzuur, 3.5% | ca. 0 | |
| Zoutzuur, 0.35% | 1.0 | |
| Maagsap | 0.9 - 2.3 | |
| Citroensap | 2.3 | |
| Azijnzuur, 6% | 2.4 | |
| Handelsazijn | 3.1 | |
| Zure melk | 4.4 | |
| Zweet | 4 - 6.8 | |
| Melk | 6.4 - 6.7 | |
| Ureum | 4.8 - 7.4 | |
| Zuiver water | 7.0 | |
| Bloed | 7.38 | |
| Meer water | 7.8 - 8.2 | |
| Zeep oplossing | 8.2 - 8.7 | |
| Natriumcarbonaat oplossing, 0.5% | 11.3 | |
| Verzadigd kalkwater | 12.3 | |
| Natronloog, 0.4% | 13.0 | |
| Natronloog, 4% | ca. 14 | |
Kijken we nu naar zoutzuur: HCl --> H+ +
Cl-
Zoutzuur is een zuur, het kan protonen afstaan. Het chloride ion heeft
echter weinig neiging een proton op te nemen, heeft dus nagenoeg geen basische
eigenschappen.
Sommige stoffen kunnen zich zowel basisch
als zuur gedragen, de amfolyten:
HCO3- + H+ <=> H2CO3
HCO3- <=> H+ + CO32-
Op de theorie van Bronsted is een uitbreiding gekomen. De reactie hierboven
geschetst kan nl in een waterige oplossing niet plaatsvinden, er moet nl een
base aanwezig zijn die het proton kan opnemen. Daarom wordt een zuur-base
reactie tegenwoordig opgevat als een protonenoverdrachtsreactie, protolyse
genaamd volgens: a1 + b2 <=> a2 + b1
Het begrip dissociatie wordt dus vervangen door protolyse (a = zuur, b = base).
Voor zoutzuur in water verloopt de protolyse volgens: HCl + H2O
<=> H3O+ + Cl- (waarbij het evenwicht
geheel rechts ligt). In dit geval functioneert water als een base aangezien het
een proton opneemt. Voor ammoniak in water geldt: HH3 + H20
<=> NH4+ + OH-. Het water functioneert nu
als zuur aangezien het een proton afstaat. Water kan zich dus als een
zuur en as een base gedrageb, het is een amfolyt die zichzelf kan protolyseren
volgens:2H2O <=> H3O+ + OH-.
Deze reactie noemt men de autoprotolyse van water en is er verantwoordelijk voor
dat zuiver water stroom kan geleiden. De autoprotolysereactie kunnen we
beschrijven volgens:
|
|
waarbij voor niet te geconcentreerde oplossingen geldt dat aH2O=1 hetgeen betekent: |
|
|
|
|
|
|
|
Hetgeen we voor water hebben gedaan kunnen we ook voor zuren en basen doen:
| ZUREN | BASEN | |
|
a + H2O <=> b + H3O+ |
b + H2O <=> a + OH- |
Voor corresponderende zuren en basen geldt in water: |
|
|
|
30-03-2004