Aantonen van Cu2+ en Fe3+


|
Aantonen van Cu2+ en Fe3+ |

|

|
Datum: December 2015
Principe: Aantonen van Cu2+ en Fe3+ m.b.v. een neerslagreactie.
Materiaal:
|
|
Uitvoering:
|
De weegschaal gebruikt men om 1% oplossingen te maken. |
|
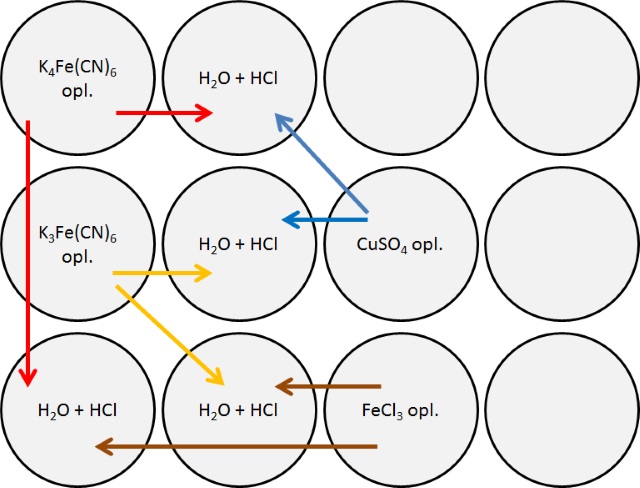 |
Resultaten:
|
Voor menging |
|
 |
|
| Na mening | |
 |
|
|
Cu2+ met geel
bloedloogzout: bruin rood neerslag |
|
| Ammonia toegevoegd | |
 |
|
|
Cu2+ met geel
bloedloogzout en ammonia: blauwkleuring/neerslag |
|
Discussie:
|
Het idee om deze reacties uit tevoeren is gebaseerd op het lezen van deze in de "Copper" website. Na wat verder onderzoek besloot ik het experiment iets uit te breiden. In eerste instantie met het aantonen van Fe3+, vervolgens met de vraag "wat gebeurt er eigenlijk als ik roodvbloedloog zout gebruik", en uiteindelijk omdat in het boek van Nieuwenburg staat dat de produkten oplosbaar zijjn in ammonia, het toevoegen van ammonia om te kijken of dat inderdaad gebeurt. |
|
De reacties met geelbloedloogzout zijn degenen die als kwalitatieve aantoningsreacties vermeld staan in de boeken van Nieuwenburg. Koper(II) reageert
met kaliumferrocyanide en zuur (verd. HCl)
onder vorming van een neerslag van het rose-rode koper ferrocyanide volgens:
2Cu2+ (aq)
+
[Fe(CN)6]4-
(aq) → Cu2[Fe(CN)6] Fe(III) regeert met kaliumferrocyaninde en zuur (verd. HCl) onder vorming van een blauw neerslag van Pruisisch blauw volgens:
4Fe3+ (aq) + 3
[Fe(CN)6]4- (aq) → Fe4[Fe(CN)6]3
|
|
De reacties met roodbloedloogzout Koper(II) reageert
met kaliumferrocyanide en zuur (verd. HCl)
onder vorming van een neerslag van het rose-rode koper ferrocyanide volgens:
3Cu2+ (aq)
+ 2
[Fe(CN)6]4-
(aq) → Cu3[Fe(CN)6] Fe(III) regeert met kaliumferrocyaninde en zuur (verd. HCl) onder vorming van een blauw neerslag van Pruisisch blauw volgens:
Fe3+ (aq) + [Fe(CN)6]4-
(aq) <=> Fe[Fe(CN)6]
|
|
De reactie met Ammonia
De blauwe kleur van de koperoplossingen kan verklaard worden met de volgende reeactie
Cu2+ (aq) + 4NH3 (aq) <=> Cu(NH3)42+ (diepblauw/paars gekleurd complex)
De roodbruine kleur van de ijzeroplossingen kan verklaard worden met de vorming van het rood-bruine Fe(OH)3: Fe3+(aq)
+ 3NH3(aq)
+ 3H2O(l)
→
Fe(OH)3(s)
+ 3NH4+(aq) |
Opmerkingen:
|
Literatuur:
|
Relevante websites:
29/12/2015