Experimenteren met Gips


|
Experimenteren met Gips |

|

|
Datum: Januari 2017
Inleiding:
| De reactie van gips met water is een exotherme reactie die men in kaart kan brengen. Gipskristallen zijn interessante objecten voor onder de microscoop. |
Materiaal:
|
|
|
|
|
Uitvoering:
| Gipskristallen onder de microscoop | |
|
 |
| Gipspoeder onder de microscoop | Uitgehard gips onder de microscoop |
|
|
| Exotherme reactie van gips met water | |
|
|
 |
|
| Controle op de zuiverheid van het gips | |
|
|
Resultaten:
|
Gipskristallen onder de microscoop |
|
|
|
|
|
Naaldvormige en gekruiste kristallen zijn duidelijk waarneembaar.Zoals ook
in onderstaande referentie tekening te zien is [1]. Met gekruiste nicols vind uitdoving plaats.  |
|
| Het gips in de verpakking bevat geen kristallen maar is opgebouwd uit een zeer fijn poeder zoals in onderstaande foto's te zien is. | |
 gipskorrels - licht |
 gipskorrels - donkerveld |
|
Uitgehard gips onder de microscoop |
|
 gips - verhard |
.jpg) gips verhard - donkerveld |
| Controle op de zuiverheid van het gips | |
|
Soms voegt men wat kalk toe aan gips. Kalk en zoutzuur reageren onder bruisontwikkeling. Zoals te zien is op de test plaat bij het kalkmonster. Het in dit experiment gebruikte gips laat geen bruisvorming zien hetgeen impliceert dat het geen kalk bevat. Dat is consistent met de verpakking (nevenstaande foto) die aangeeft dat het zuiver calciumsulfaat is. Reactie
van kalk met zuur: |
|
 |
|
| Exotherme reactie van gips met water | |
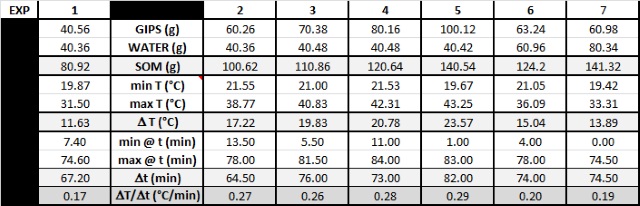
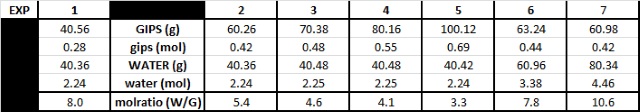
| Alle meetresultaten zijn samengevat in onderstaande grafiek en samengevat in onderstaande tabel. | |
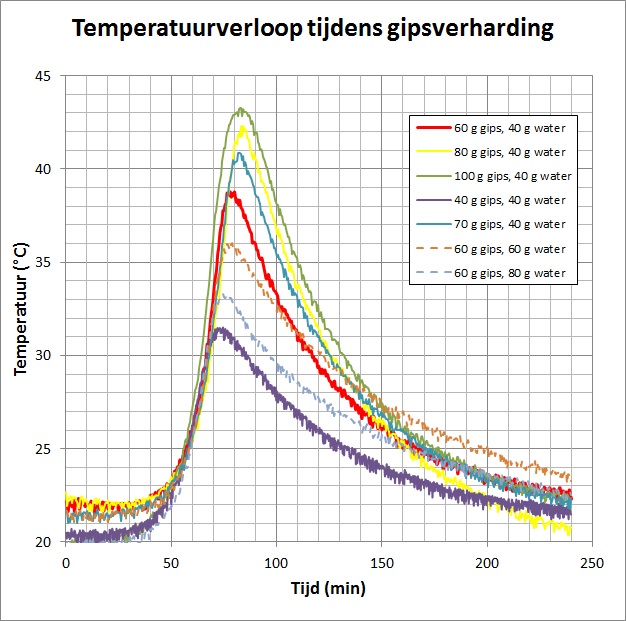 |
|
| Samenvatting experimenten en resultaten. | |
 |
|
Discussie:
| Het zeer bekende Gips staat bij de chemicus bekend als calciumsulfaat (CaSO4). Gips komt in verschillende kristalvormen voor. De kristalvorm is van invloed op de hoeveelheid water die nodig is om een gietbare gipsbrij te kunnen maken. Gips kan bestaan in verschillende vormen. De meest bekende is de hemihydraat-vorm waarbij 1 molecuul kristalwater gekoppeld is met 2 moleculen calciumsulfaat. Als men het hemihydraat-poeder mengt met water neemt het hemihydraat water op en wordt dan uitgeharde gips. Dit uitgeharde gips vormt nieuwe kristallen die langzaam uitgroeien tot grotere kristallen. Deze grotere kristallen haken in elkaar hetgeen uiteindelijk resulteert in de ons welbekende harde massa. | |
Als reactievergelijking:
|
|
Het hierboven beschreven proces noemt men ook wel de dissolutie -
precipitatie theorie.
Zoals men kan zien komen tijdsschaal en temperatuurverandering overeen met de verzamelde experimentele resultaten. |
|
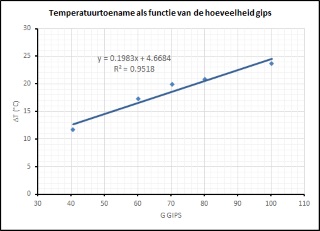
| Indien we de temperatuurtoename weergeven als functie van de hoeveelheid gips die we in bewerking nemen waarbij we de hoeveelheid water die we toegevoegd hebben constant houden (40 g) dan vindt men een (redelijk) lineaire relatie. |
 |
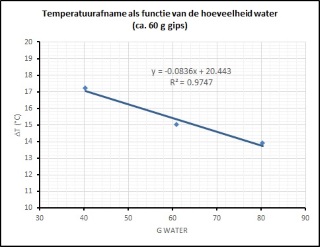
| Rond de 60 g gips is de hoeveelheid toegevoegd water gevarieerd. Indien we de temperatuurafname weergeven als functie van de hoeveelheid water die we in bewerking nemen dan vindt men wederom een (redelijk) lineaire relatie. Des te meer water men toevoegt des te kleiner de temperatuurstijging, alhoewel het effect relatief klein lijkt te zijn. |
 |
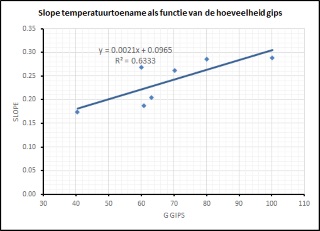
| In nevenstaande grafiek is de hellingshoek van de temperatuurtoename weergegeven als functie van de hoeveelheid gips die in bewerking is genomen voor alle meetresultaten. Op zich wijkt deze grafiek niet wezenlijk af van de reeds gepresenteerde grafieken. |
 |
| Kijken we op een ietwat fundamentelere manier naar de experimenten die we uitgevoerd hebben. | |
 |
|
|
Dan zien we dat we deze experimenten met een
ruime overmaat aan water uitgevoerd hebben. De reactievergelijking laat zien
dat we in principe maar anderhalve mol water nodig hebben om de reactie te
laten verlopen. 2CaSO4.½H2O + 3H2O -- > 2CaSO4.2H2O Een overmaat water toevoegen draagt er aan bij om de reactie helemaal naar rechts te laten verlopen. Deze overmaat is verder echter "inert" en verklaart waarom extra water toevoegen een "remmende" werking heeft op de geobserveerde temperatuurtoename. De massa van het systeem neemt toe hetgeen betekent dat de geproduceerde warmte over deze grotere massa/volume verdeeld moet worden (Wet van Newton). |
|
|
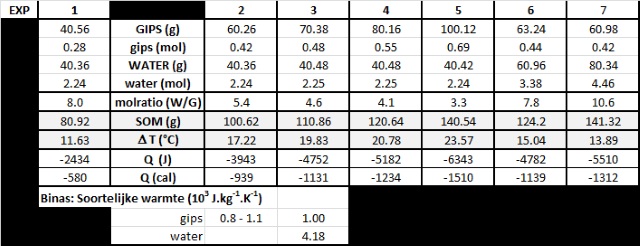
Een vraag die we nog kunnen proberen te
beantwoorden is of het mogelijk is om de hoeveelheid geproduceerde warmte te
kwantificeren en te relateren aan het reactieverloop. Voor het kwantificeren van de hoeveelheid warmte kunnen we gebruik maken van warmtecapaciteitberekeningen. In dit geval: Q = m.Cp.DT De resultaten zijn samengevat in onderstaande tabel. |
|
 |
|
|
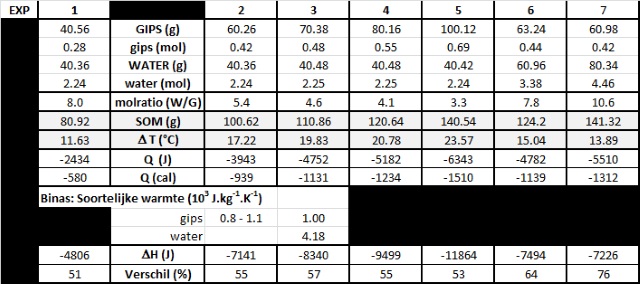
Dit resultaat kan men dan weer relateren aan
de theoretische reactiewarmte die men kan berekenen m.b.v. de Wet van Hess. DH = SDHf Producten - SDHf Reactanten Vorminsgwarmte hemihydraat : -1575.2
kJ/mol Reactiewarmte:
DH =
(-2021.1) - (-1575.2-428.7) = -17.2 kJ/mol Koppelen we deze waarde aan de hoeveelheid gips die bij de reactie betrokken was dan verkrijgen we onderstaande getallen. |
|
 |
|
|
Het verschil tussen berekende en gemeten reactiewarmte is nogal groot. Dit impliceert volgens mij vooral dat we met suboptimale calorimeters gewerkt hebben waarbij we met veel warmteverlies naar de omgeving te maken hadden. |
|
Opmerkingen:
|
Literatuur:
Relevante websites: Minder relevante websites: |
Achtergrondinformatie:
|
Gips, is een zacht mineraal dat gemijnd wordt op verschillende plaatsen in de wereld waarbij het meestal gevonden wordt in de hemihydraat vorm (CaSO4.2H2O).De chemische benaming van gips is calciumsulfaat. Gips kan bestaan in drie vormen:
Meest bekende minerale vormen:
Bereiding:
|
06/02/2017