Koperchloride


|
Koperchloride |

|

|
Datum: Maart-April 2019
Inleiding:
| Het maken van en experimenteren met koperchloride. |
Materiaal:
|
|
 |
|
 |
 |
Uitvoering:
Synthese van Koperchloride
|
 |
| Microscopische onderzoek | |
Indampmethode
|
 |
| Koperboom | |
|
 |
 |
|
| Vlamproef | |
|
|
 |
|
Resultaten:
| Synthese | |
|
Men kan naaldvormige kristallen waarnemen met een lichtgroene kleur.
Als men een beetje materiaal neemt en dit in een reageerbuis met water plaats kan men observeren dat het materiaal slecht oplost. Voegt men echter een beetje zoutzuur toe dan lost het materiaal wel op en ontstaat een oplossing met een lichtblauwe/groenige kleur. Meet men de pH van de oplossingen met een pH papiertje dan geeft de troebele oplossing een pH van 4 en de aangezuurde oplossing een pH van 1-2. Van beide oplossingen heb ik vervolgens een druppel op een objectglaasje gelegd, ingedampt op de verwarmingsplaat en microscopisch onderzocht. Een beetje van het poeder is ook opgelost in enkel ml aceton. |
 |
 |
|
| De oplossing in aceton wordt bruin. Het materiaal lost goed op. | |
 |
|
| Preparaten (boven heldere oplossing, onder troebele oplossing) | |
 |
|
| Indien men het preparaat van de heldere oplossing verder droogt wordt het ook bruin van kleur. Onder de microscoop laten beide preparaten naaldvormige kristallen zien. | |
 |
|
| Laat men de preparaten enige tijd liggen dan worden ze weer lichtblauw. | |
 |
|
| Microscopisch onderzoek - Algemeen | |
| Euromex ML 2000, Luckyzoom YW500 HD 5MP USB Cmos Camera Electronic Digital Eyepiece, Objectief 4x | |
| Licht | |
 |
|
| Gepolariseerd | |
 |
|
|
Donkerveld |
|
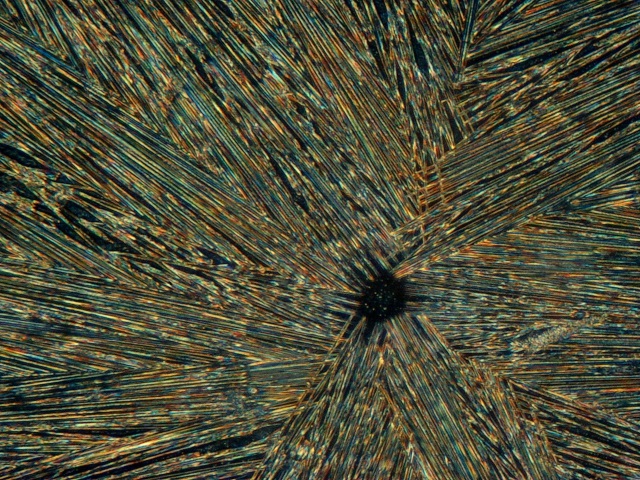 |
|
| Koperboom | |
| Men kan op het contactvlak van aluminium en koperchloride een koperboompje zien groeien | |
 |
|
.jpg) |
|
 |
|
| Een filmpje van het
groeiproces heb ik op YouTube gezet.
YouTube link: Koperboom |
|
| Vlamproef | |
| De groene kleur is typerend voor de
aanwezigheid van koper. De gele vlam geeft de aanwezigheid van natrium aan. |
 |
|
YouTube link: Vlamproef |
|
|
YouTube link: Spectroscoop |
|
|
In de spectroscoop zijn we vnl een gele lijn intenser worden (de Natrim D lijn). Vooral op het einde kunnen we soms ook groene lijnen zien oplichten. De resolutie van de spectroscoop is niet extreem hoog. |
|
|
|
|
Discussie en conclusie:
| De vraag die we willen beantwoorden is of we inderdaad het gewenste koperchloride hebben gemaakt. |
|
Dat onze oplossing koper bevat is een gegeven
dat op verschillende manieren bevestigd is nl de gebruikte synthesemethode,
de vorm en kleur van het preparaat, kristallen en oplossingen, het geven dat
we vanuit de oplossing weer koper kunnen maken en uiteindelijk de groene
keur bij de vlamproef. De groene vlamkleur die we regelmatig kunnen waarnemen laat zien dat er een koper verbinding in de oplossing aanwezig is. Alhoewel de gele vlam domineert, laat deze zien dat er ook aardig wat Natrium aanwezig is. Natrium is echter bijna altijd aanwezig (lekt bv. uit glas) maar kan ook al aanwezig zijn geweest in de chemicaliŽn die we gebruikt hebben (de zoutzuur was niet van analytische kwaliteit). De echte vraag is dan of we het gewenste koper(II)chloride hebben gemaakt aangezien men ook een koper(I)chloride, koperhydroxide of kopercarbonaat gemaakt kan hebben. Koperhydroxide en kopercarbonaat zijn ook onoplosbaar in water, en alhoewel ons preparaat niet echt goed oplost in water, lost er duidelijk wel een deel op. Dat we een hydroxide of carbonaat hebben gemaakt is onwaarschijnlijk doordat ook de troebele oplossing nog steeds zuur is. De vraag of we met Koper(I) of Koper(II) te maken hebben. Koper(II)chloride, ook wel bekend onder de naam cuprichloride, vormt in zijn dihydraat vorm (CuCl2.2H2O) een blauwgroene, orthorombische kristallijne structuur. Het is een zwak Lewis zuur oplosbaar in water. De niet-gehydrateerde heeft een bruine kleur en is hygroscopisch. Door zijn relatief lage reactiviteit is koperchloride (het Cu2+) een goede oxidator. Koper(I) verbindingen zijn al vrij lastig te maken maar er zijn duidelijke aanwijzingen dat we met koper(II)chloride te maken hebben.
|
| Reactie van aluminium metaal met de koper(II)chloride oplossing |
|
In dit systeem vindt een redoxreactie plaats.
Al is de reductor (-1.67 V) en Cu2+ de oxidator (0.34 V). De halfreacties
die hier optreden zijn:
Al (s) <=> Aln3+ + 3 e- Cu2+ + 2 e- <=> Cu (s) Het werkelijke systeem is chemisch gezien iets complexer. Er vinde ook nog wat nevenreacties plaats. Het aluminium ion dat gevormd wordt coŲrdineert met 4 chloride ionen en vormt dan [AlCl4]-. Koper(II)ionen zullen hydrolyseren en zo H+ ionen vormen, waardoor de oplossing lichtelijk zuur wordt (hetgeen we ook geobserveerd hebben, pH=4). Aluminium metaal is altijd bedekt met een beschermende laag aluminiumoxide (Al2O3). Het chloride ion helpt om het aluminum lost te maken van het zuurstof zodat het met de koperionen en de watermolekulen kan reageren. Cu2+ + HOH <=> CuOH+ + H+ Al2O3 + 4C1- + H2O + 2H+ <=> 2[Al(OH)2Cl2]- De reactie gaat ook gepaard met de vorming van waterstof gas: 2Al + 6H+ <=>2Al3+ + 3H2
|
|
Voor de verklaring van de boomachtige
koperstructuur die ontstaat helpt het om de literatuur te raadplegen. Koper kristalliseert uit in de hexakisoktaŽdrische klasse van het kubische stelsel in de vorm van octaŽders, kubussen en rhombendodekaŽders. Deze verdubbelen zich analoog aan de spinellen hebben de neiging evenwijdig in dendritsche of boomvormige aggregaten te vergroeien. Door hun weekheid verliezen de kristallen gemakkelijk hun sterke kanten zodat ze afgeronde vormen aannemen, ze zijn zwaar en hebben een diepe glans. |
|
De dendritsche structuur ontstaat omdat de
diffusie langzaam verloopt en de groei diffusiegelimiteerd verloopt (DLA). Als de diffusie langzaam is groeit een
kristal naaldvormig, om bij materiaal te komen dat nodig is voor de groei
(groter oppervlak) en ontstaat een dendritisch of skeletaal kristal. De groei van het dendriet uitgaande van een primair koperkristal is schematisch weergegeven in onderstaande figuur. |
|
|
Opmerkingen:
|
Literatuur:
Relevante websites:
Koper(II)hydroxide - WikipediaRiddle: A copper (I) / copper (II) mixed oxidation state complexMinder relevante websites: |
Achtergrondinformatie:
|
Het maken van een permanent preparaat
|
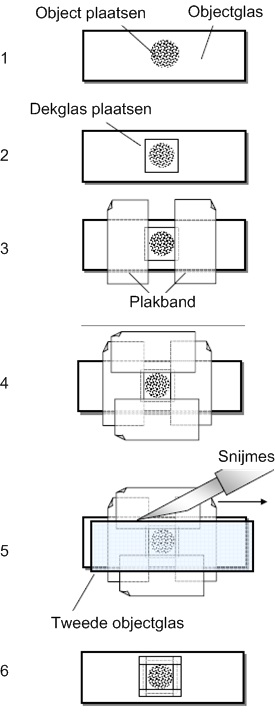 |
06/05/2019