Dialysemembraan


|
Dialysemembraan |

|

|
Datum: Januari 2019
Inleiding:
| Experimenteren met een dialysemembraan |
Materiaal:
|
  |
|
|
|
Uitvoering:
|
|
|
|
 |
|
 |
|
|
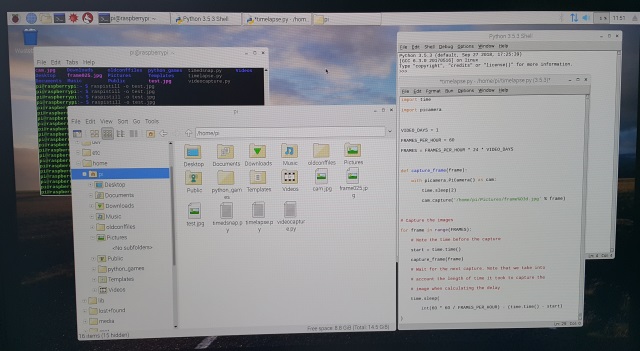
Pythoncode voor het nemen van time lapse foto's: import time |
|
Resultaten:
|
YouTube link: Dialysemembraan |
|
| Men kan een verkleuring van de zetmeeloplossing in het dialysemembraan waarnemen hetgeen aangeeft dat de jood molekulen in contact zijn gekomen met het zetmeel. | |
Discussie:
|
Zoals in Achtergrondinformatie meer formeel
beschreven wordt is diffusie de verplaatsing van een stof van een plaats met
een hoge concentraties naar een plaats met een lage concentratie van die
stof.
In gassen en vloeistoffen in evenwicht bewegen zich deeltjes (moleculen) volledig willekeurig, de zogenaamde Brownse beweging. Diffusie komt tot stand doordat in een systeem dat niet in evenwicht is, doordat er een concentratie gradiŽnt aanwezig is, zich gemiddeld genomen meer moleculen richting de lagere concentratie bewegen, totdat het systeem weer in evenwicht is (concentratie gelijk is). |
|
|
|
Men kan osmose beschouwen als een speciaal
geval van diffusie nl de diffusie van water van een oplossing met een lagere
concentratie naar een oplossing met een hogere concentratie van een bepaalde
component. Dat kan echter alleen maar plaatsvinden als de oplossingen
gescheiden zijn door een membraan waar water wel doorheen kan maar de
component dus niet. Men spreekt dan van een halfdoorlatend of
semipermeabel membraan. De beweging van de watermoleculen noemt men dan geen
diffusie meer maar osmose.
Het dialysemembraan zoals we het in dit experiment gebruikt hebben filtert als het ware op grootte. Water en jood ionen passen wel door de poriŽn in het membraan, de veel grotere zetmeel moleculen echter niet. |
 |
Opmerkingen:
|
Literatuur:
Relevante websites: Minder relevante websites: |
Achtergrondinformatie:
| Jood-zetmeel complex | |
|
De kleurreactie waarvan we gebruik maken in dit experiment is die van Jood
met zetmeel waarbij een donkerblauwe kleur gevormd wordt. Een donkerblauwe
kleur is ook beter te zien tegen een witte achtergrond waardoor dus tevens
de gevoeligheid (detectiegrens)van de reactie verbeterd wordt. Een groot aantal maltose-eenheden door een 1a-4 binding aan elkaar gekoppeld levert zetmeel op volgens: 1/2 n C12H22O11 --> (C6H10O5)n + 1/2 n H2O Er komen echter ook vertakkingen voor en zetmeel is hierdoor colloÔdaal oplosbaar in water (en dat heet stijfsel). RŲntgen analyse van zetmeel heeft laten zien dat de ketens gedraaid zijn in de vorm van een helix (als een wenteltrap). |
|
|
In de helix is net genoeg plaats voor een jodium-molecuul.
De blauwe kleur wordt veroorzaakt door de gevangen jodiummoleculen. Er
is dus niet echt sprake van een reactie. Er ontstaat een zetmeel-jodium
complex en dat geeft de blauwe kleur. Deze reactie is niet specifiek aangzeien elke stof die met jodide een redox-reaktie kan aangaan waarbij jood gevormd wordt in principe de donkerblauwe kleur zal laten ontstaan. Ook dient hier opgemerkt te worden dat als jood opgelost wordt in water in aanwezigheid van jodide ionen de tri-jodide en penta-jodide ionen gevormd worden volgens:I2 + I- --> I3- I2 + I3- --> I5- De ionen worden lineair gerangschikt in het complex. |
|
|
Massatransport |
|
|
Componenten die zich binnen een fase
bewegen doen dit onder invloed van een concentratieverschil.
Er ontstaat dus een stroom als gevolg van een oorzaak, de ďdrijvende krachtĒ. Voor een korte lengte Dx kunnen we dan een debietvergelijking opstellen:
HerdefiniŽren we deze in termen van eendimensionaal stationair transport dan krijgen we de wet van Fick waarin we de fluxvergelijking opstellen:
Volgens deze wet is de diffusiesnelheid rechtevenredig met het concentratieverval. Hierin is D de diffusiecoŽfficiŽnt in m2s-1. Het is een temperatuurafhankelijke stofeigenschap en is een maat voor de snelheid waarmee in het betreffende medium stof diffundeert. Voor de diffusiecoŽfficiŽnten in vloeistoffen vindt men bij kamertemperatuur waarden in de orde van 10-8 a 10-9 m2s-1; voor andere temperaturen kan men een bij een temperatuur gegeven diffusiecoŽfficiŽnt omrekenen met de relatie van Einstein-Nernst-Eyring: Dh/T (h is de viscositeit van het oplosmiddel).Beschouwen we nu een materiaalbalans over een schijfje met dikte dx en met als oppervlak de eenheid van oppervlak (het volume van het schijfje is dus dx).
De balans luidt: in = uit + accumulatie
Hetgeen de tweede wet van Fick is die informatie geeft over de concentratieverandering in de tijd. |
|
05/06/2019