Experimenteren met een Calorimeter (Coachlab)


|
Experimenteren met een Calorimeter (Coachlab) |

|

|
Datum: Maart-Mei 2020
Inleiding:
| Ik heb deze calorimeter al een tijdje geleden bij AliExpress gekocht en het werd tijd om er mee te experimenteren. |
Principe:
| De dubbelwandige calorimeter kan gebruikt worden om de specifieke warmte van vast stoffen te bepalen. Door gebruik te maken van het ingebouwde verwarmingselement kan men het elektrische equivalent bepalen. |
Materiaal:
|
|
|
Calorimeter: De binnenbeker heeft een volume van 150 ml en is naar buiten toe ge´soleerd m.b.v. schuimplastic en een plastic afdichtring. Het transparante deksel bevat openingen voor het verwarmingselement, de roerder en een kurk waar een thermometer doorheen past. De verwarmingsspiraal opereert m.b.v. een 0 - 6 V, 1.7 - 2A gelijkspanningsbron. 100 ml water wordt in 10 min met 10 ░C verwarmd. De weerstand van de verwarmingsspiraal is ca. 2 - 3 Ohm. |
|
|
|
|
Uitvoering:
| Bouw de opstelling op zoals weergegeven in onderstaand schema. | |
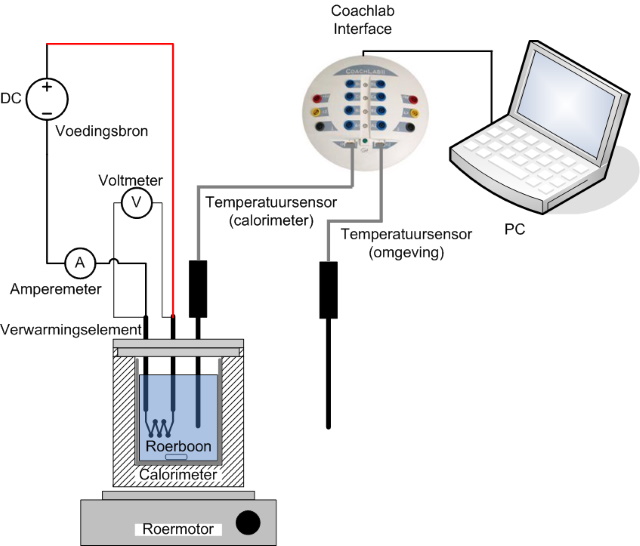 |
|
| Bepalen van de weerstand van de weerstandsdraad | |
|
|
| Bepalen van de soortelijke warmte van water | |
|
|
 |
|
|
|
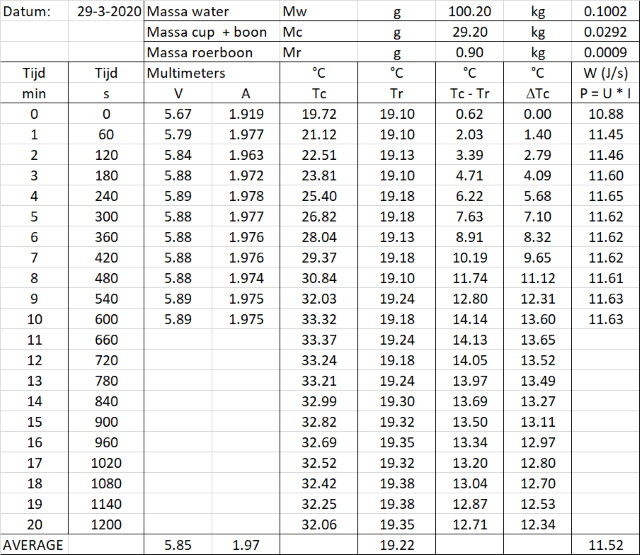 |
|
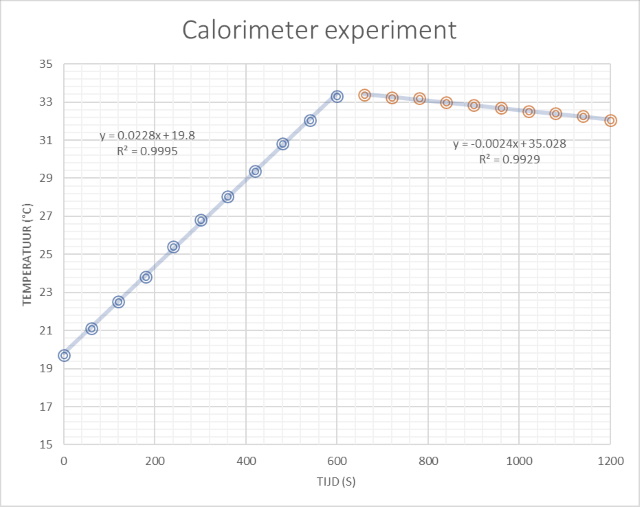 |
|
|
|
| Experimentele bepaling van de soortelijke warmte van aluminium | |
|
|
 |
 |
| Experimentele bepaling van de oplossings Enthalpie van Kalikumchloride | |
|
|
nm
Resultaten en discussie:
| Bepalen van de soortelijke warmte van water | |
|
Als warmte toegevoegd wordt aan een vloeistof
of een vaste stof dan wordt deze warmte gebruikt om de interne energie van
het system te verhogen hetgeen we waarnemen als een temperatuursstijging. De
relatie tussen de geleverde warmte en de temperatuur wordt weergegeven door:
Q = m.Cp.DT Volgens de elektriciteitsleer is de warmte
die in een weerstand ontwikkeld wordt gelijk aan: Waarin DQ de ontwikkelde warmte in de weerstand is in J, U de spanning over de weerstand in V, I de stroomsterkte in A en Dt de tijd dat de stroom loopt. Deze door de weerstand ontwikkelde warmte wordt opgenomen door het water en door de calorimeter. De warmte die door de calorimeter wordt opgenomen is mc.cc.DT. De warmte-uitwisseling kunnen we dan uitschrijven als: U.I.Dt = mw.cp.Dt + mc.cc.DT Op de soortelijke warmte van de vloeistof en die van de calorimeter na kunnen we alle waarde meten. De "soortelijke warmte van de calorimeter" kunnen we echter wel afschatten omdat alleen het aluminium (+ de roerboon) warmte opneemt. Door nu de warmtecapaciteit van Aluminium te nemen kunnen we de warmtecapaciteit van de calorimeter afschatten m.b.v. cc = mAl.cp(Al) [895 J/(kg.K)] = 29.1/1000 * 895 = 26 J/K. Tijdens het experiment meten we de temperatuur in de calorimeter (water) als functie van de tijd. Door deze twee grootheden grafisch uit te zetten ontstaat een rechte lijn met een richtingscoŰfficiŰnt DT/Dt. De soortelijke warmte van de vloeistof in de calorimeter (water) kunnen we hiermee bepalen door de formule van warmte-uitwisseling te gebruiken om de vergelijking van de richtingscoŰfficiŰnt (rc) uit te schrijven: rc= DT/Dt = U.I/(mw.cp + mc.cc) ==> cp = (U.I - rc.mc.cc)/(rc.mw) Analyseren we nu de verzamelde data op deze manier dan verkrijgen we onderstaande tabel. Om te kijken of het gebruik van een
roerboon invloed zou uitoefenen op de resultaten heb ik een aantal
experimenten uitgevoerd zonder roerboon en gebruik gemaakt van de ingebouwde
roerder. In de berekeningen voeg ik de massa van de roerboon toe aan de
aluminium beker en behandel deze als zijnde aluminium. |
|
|
|
|
|
Deze eerste resultaten laten een relatief grote afwijking t.o.v. de theoretische waarde zien. Gezien deze onnauwkeurigheid maakt het niet veel uit of men wel of niet gebruik maakt van een roerboon. Een langere opwarmtijd lijkt de meting ook niet nauwkeuriger te maken. |
|
| Een van de mogelijke fouten die we in de berekening maken is dat we de warmtecapaciteit van de calorimeter onnauwkeurig bepalen. Om te kijken of ik deze wat beter kon berekenen heb ik twee methodes toegepast. Het gebruik van een afkoelingscurve en het berekenen van de hoeveelheid toegevoegde warmte en de meer officiŰle methode waarbij we gebruik maken van de warmtecapaciteit van water. | |
|
Bepalen van de weerstand van de weerstandsdraad en afschatten van de warmtecapaciteit van de calorimeter. |
||
|
Op de calorimeter wordt een waarde van 2-3 Ohm opgegeven. We meten een weerstandwaarde van 2.7 Ohm. |
|
|
 |
||
|
De warmteproductie van een stroom die door een geleider loopt kan berekend
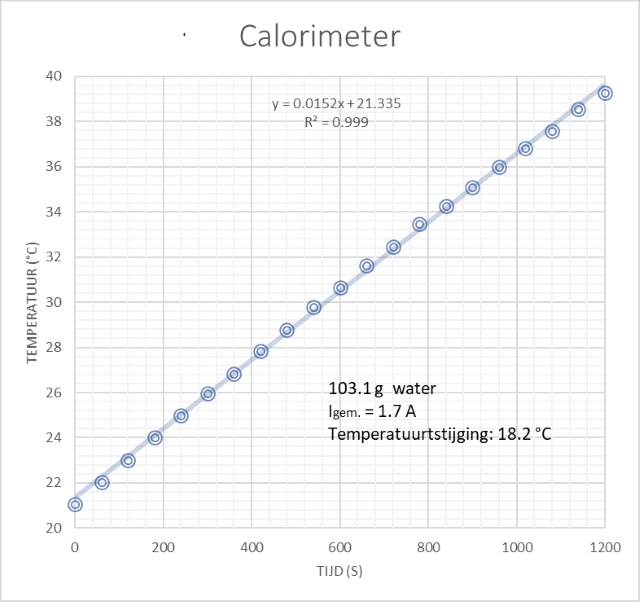
worden met de Wet van Joule. Die luidt: Q = P.t = U.I.t = R.I2.t Waarin Q de warmteproductie is in J, U de elektrische spanning over de weerstand in V, P het vermogen in J, I de stroomsterkte door de weerstand in AmpŔre en t de tijd in s. Gedurende 20 minuten opwarmtijd is de warmteproductie met een gemiddelde stroomsterkte van 1.7 A dan: Q = 2.7 * (1.7)2 * (20*60) = 9396 J. Voor 103.1 g water geeft dat een temperatuursverhoging van: DT = Q/(Cp.mw) = 9396 / ( 4186 * 0.1031) = 21.8 ░C In werkelijkheid vinden we een temperatuursverhoging van 18.2 ░C, een afwijking van 20% relatief. |
||
 |
||
|
Kennen we dit verschil toe aan warmteverlies aan de omgeving dan kunnen we met dit verschil de warmtecapaciteit van de calorimeter afschatten nl. Q voor een DT van 18.2 ░C = DT.m.Cp =18.2 * 0.1031 * 4186 = 7855 J Verschil = 9364 - 7855 = 1509 J Ccal = 1502 / (21.8 - 18.2) = 417 J/K Een getal dat in eerste instantie veel te hoog lijkt, zeker vergeleken met de eerste afschatting van 26 J/K. Procedureel kan ik zo snel echter geen fout in mijn redenering vinden. Misschien dat het te maken heeft met een verandering van de weerstandwaarde als de temperatuur veranderd, bij hogere temperatuur neemt deze toe.
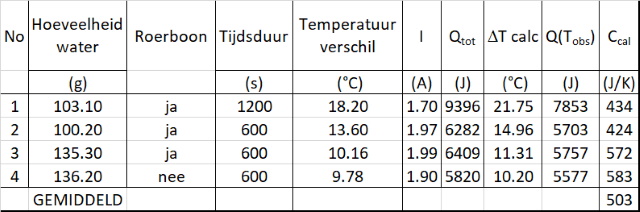
Passen we deze methode toe op alle
waarnemingen dan krijgen we onderstaande tabel: |
||
 |
||
|
Hetgeen bevestigd dat deze methode niet echt geschikt is om de warmtecapaciteit van de calorimeter te berekenen. |
||
|
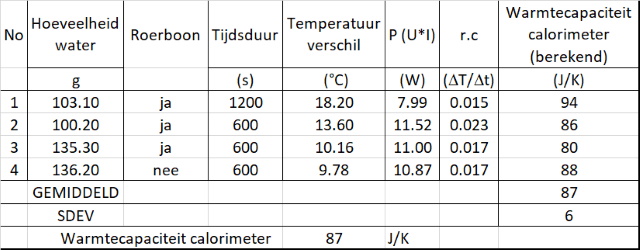
Bij de meer officiŰle methode gebruiken we wederom de soortelijke warmte van water volgens: U.I.Dt/DT = mwCw.DT + Ccal.DT==> Ccal = P/r.c. - Cw.mw
Dan verkrijgen we onderstaande tabel. |
||
 |
||
|
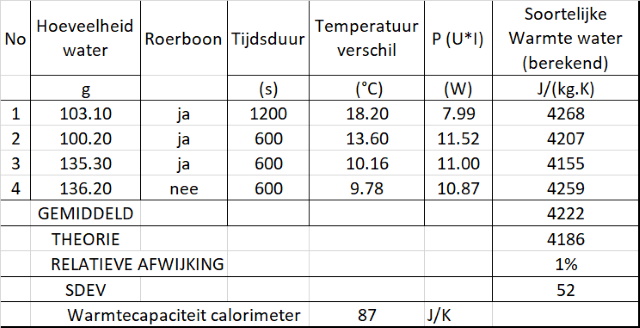
Dat lijkt een meer realistisch getal te zijn, meer in lijn met de eerdere schatting en meer in lijn met wat men in de literatuur vindt. Gebruiken we deze gemiddelde waarde om de warmtecapaciteit van water te berekenen dan krijgen we onderstaande tabel: |
||
 |
||
|
Al met al geeft deze methode tot op dit moment
wel een beetje een wceend gevoel (Wij van WC eend adviseren WC eend) en ik
vroeg me dus af of ik de afkoelingscurves kon gebruiken om tot een betere
afschatting van de warmtecapaciteit van de calorimeter te komen. Na wat
nadenken moest ik echter concluderen dat ik er niet onderuit kwam om wederom
de soortelijke warmte van water te gebruiken, hetgeen mijn probleem dus niet
oploste. Een andere manier om te bepalen of men de warmtecapaciteit van de calorimeter enigszins goed bepaald heeft is door de soortelijk warmte van een ander materiaal te bepalen zoals bv. Aluminium |
||
| Experimentele bepaling van de soortelijke warmte van aluminium | ||
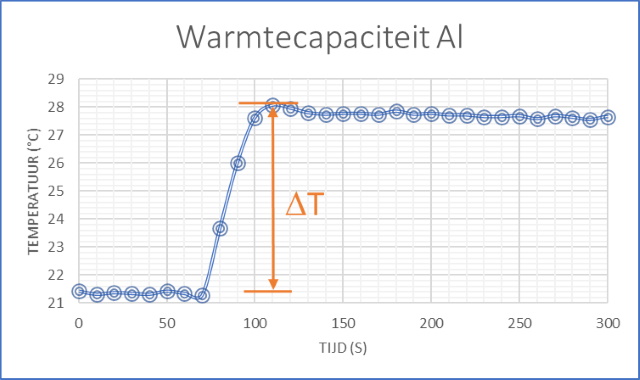
| We hebben het experiment twee keer uitgevoerd met hetzelfde blok Aluminium van 65.1 g. In Exp 1 is 120.5 g water in behandeling genomen en in Exp 2 124.3 g water. In onderstaande grafiek wordt het resultaat van het tweede experiment getoond. | ||
 |
||
|
Als men het blok Aluminium in de calorimeter
plaatst zullen de calorimeter en het water warmte opnemen terwijl het
blok warmte zal afgeven. De opgenomen warmte: Qop = QH2O + Qcal = mw.Cw.DT + Ccal.DT (J) Hierin is DT het temperatuurverschil zoals waargenomen in bovenstaande grafiek (Tmax-Tmin) De afgegeven warmte: Qaf = QAl =mAl.CAl.DTAl (J) Hierin is DTAl het temperatuurverschil van het Al blok op het moment dat het in de calorimeter geplaatst werd (100 ░C) en de maximale temperatuur zoals waargenomen in bovenstaande grafiek. Aangezien: Qop = Qaf Kan me de soortelijke warmte van Aluminium berekenen volgens: CAl = Qop/(mAl.DTAl) J.(kg.k) De resultaten zijn samengevat in
onderstaande tabel. |
||
|
|
||
|
Een mogelijke verklaring voor het waargenomen verschil is dat het Aluminium blokje al een beetje afgekoeld is als men het in de calorimeter plaats. De temperatuur zal iets onder de 100 ░C liggen. Dat dit een redelijke aanname is blijkt als we het even narekenen met een temperatuurdaling van 3 ░C van het Aluminium. |
||
|
|
||
| Experimentele bepaling van de oplossings Enthalpie van Kaliumchloride | ||
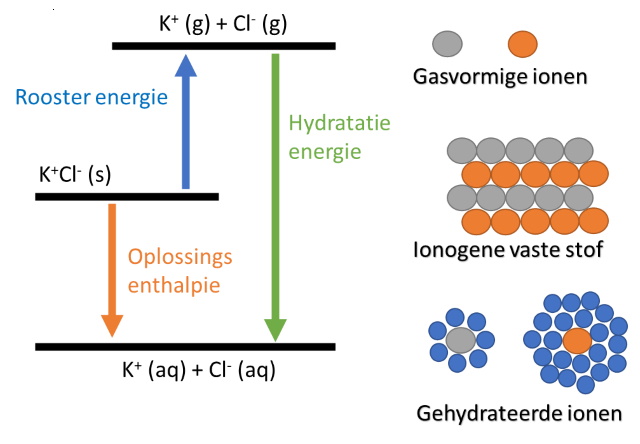
| Om een zout waarvan de ionen vast zitten in een ionogeen rooster op te lossen moeten de ionbindingen verbroken worden. Dat betekent dat de roosterenergie in het systeem ingevoerd moet worden, een endorherme reactie, waarna de ionen gesolvateerd worden door de oplosmiddel moleculen, hetgeen zowel een endotherme als een exotherme reactie kan zijn. Deze clusteren rondom de ionen. | ||
 |
||
|
De kristallisatie enthalpie van KCl is -715 kJ/mol.
De hydratatie enthalpie van kalium en chloride ionen zijn respectievelijk -322
en -363 kJ/mol. De hydratatie enthalpie van KCl is dan: ΔHhyd=−322+(−363)=−685kJ/mol De oplossings enthalpie is dan: ΔHsol =−685−(−715) = 30 kJ/mol Bij een endotherme reactie is ΔHsol positief, bij een exotherme reactie negatief. Men meet een temperatuurverandering t.o.v. de omgeving op basis waarvan de de warmte-uitwisseling berekend wordt. De Enthalpie heeft het tegenovergestelde teken van de berekende energie. DH = -Q Q berekenen we in dit experiment wederom met de formule: Q = m.Cp.DT Hierin is: De solvatatie energie brekenen we dan volgens: ΔHsol = - Q/ n Hierin is: |
||
|
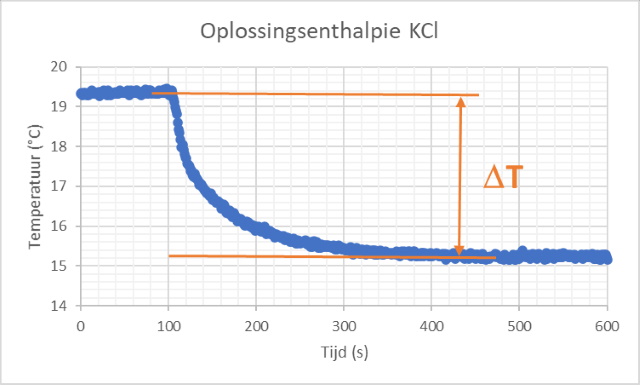
Onderstaande grafiek is een grafische weergave van een van de twee uitgevoerde metingen. |
||
 |
||
| In onderstaande tabel zijn de resultaten samengevat. | ||
|
|
||
|
De theoretische waarde die hier geciteerd
wordt komt uit het artikel van Kilday. Men kan zichzelf onmiddellijk twee
vragen stellen. 1. Kunnen we het verschil tussen meting en theorie verklaren? 2. Kunnen we het verschil tussen de door ons berekende waarde en de waarde opgegeven in de literatuur verklaren? |
||
|
In bovenstaande berekening was de warmte
capaciteit van de calorimeter nog niet meegenomen. Als we dat wel doen
verkrijgen we onderstaande tabel: |
||
|
|
||
|
De afwijking met de literatuur is iets kleiner
geworden maar wijkt nog steeds ca. 5 % relatief af. Er zijn nog wat andere foutenbronnen die een bijdrage aan de afwijking kunnen leveren, zoals b.v.: 1. De KCl in niet echt zuiver, we hebben brouwzout gebruikt hetgeen niet van p.a. kwaliteit is. 2. Variaties in de deeltjesgrootte be´nvloeden de snelheid van oplossen hetgeen een uitsmerend effect kan hebben. 3. Concentratie effecten kunnen een rol spelen. Meestal gaat men in de literatuur uit van oneindig verdunde oplossingen. |
|
| Waar ik het meeste mee worstel is het verschil tussen de literatuur/meet waarde en de theoretisch berekende waarde, dat scheelt bijna een factor 2. | |
|
Een van de mogelijke verklaringen waar ikzelf
aan zat te denken is dat het vormen van een watermantel rond een ion bepaald
wordt door de ladingsdichtheid van de ionen en wat dat betreft scoren zowel
kalium als chloride ionen slecht. Ik heb echter geen uitgespitte verklaring kunnen vinden die dit verschil goed verklaart. |
|
Conclusies:
|
Opmerkingen:
|
Literatuur:
|
Relevante websites:
Minder relevante websites:
|
Achtergrondinformatie: Bepalen van de hoeveelheid warmte Willen we iets te weten komen over de hoeveelheid warmte die vrijkomt bij of nodig is voor een proces, dan gebruiken we een calorimeter. Een calorimeter is een toestel waarbij de warmte-uitwisseling met de omgeving tot het uiterste wordt beperkt. Zo wordt er voor allerlei bepalingen (soortelijke warmte, verdampingswarmte, smeltwarmte, etc.) gebruik gemaakt van een calorimeter. In principe kan men reeds warmte meten mbv een metalen bakje met een dunne wand. Dit bakje wordt dan op een laagje plastic gezet. In het bakje worden een thermometer en een roerder geplaatst. Verder is het bakje met water gevuld. Door het water te roeren wordt ervoor gezorgd dat de temperatuur overal in het bakje gelijk is. Een laboratorium calorimeter lijkt erg veel op bovenstaande opstelling er zijn echter een paar belangrijke verschillen. Het belangrijkste onderdeel is een koperen bak. Deze bak is omgeven door een tweede bak, zodat er een isolerende luchtlaag ontstaat hetgeen resulteert in een minimum aan warmte-uitwisseling met de omgeving. Daarom is de binnenste bak een laag kurk geplaatst en is het geheel afgeschermd door een deksel van perspex, waardoor een thermometer en een roerder kunnen worden gestoken. De roerder heeft de vorm van een ring zodat bij het op en neer bewegen de vloeistof tot stroming wordt gebracht. Hierdoor vindt er een snelle en gelijkmatige warmteverdeling plaats. Daar de calorimeter, de thermometer en de roerder, bij menging van twee stoffen van verschillende temperatuur, temperatuurveranderingen ondergaan , moet het aantal Joule dat de calorimeter met toebehoren, per graad temperatuurstijging opneemt (dit is de warmte capaciteit van de calorimeter) bepaald zijn. Bij het verrichten van metingen met de calorimeter moet er op toegezien worden dat de begin- en eindtemperatuur van de calorimeter zo worden gekozen, dat deze symmetrisch liggen t.o.v de. kamertemperatuur. Dit om eventuele warmte-afgifte aan en warmte-opname van de omgeving zoveel mogelijk aan elkaar gelijk te maken, waardoor de hierdoor optredende fout zo klein mogelijk wordt gehouden. De warmteafgifte of warmteopname q naar of van een massa m is gerelateerd aan de te temperatuursverandering DT volgens: q = Cp.m.DT waarbij Cp de specifieke warmte capaciteit van die massa is bij constante druk. Voor water: Cp = 4.18 J/(g.░C) |
16/05/2020