Sublimatie AmmoniumChloride


|
Sublimatie AmmoniumChloride |

|

|
Datum: Januari 2020
Principe:
| Experimenteren met sublimatiemethodes |
Materiaal:
|
|
Uitvoering:
|
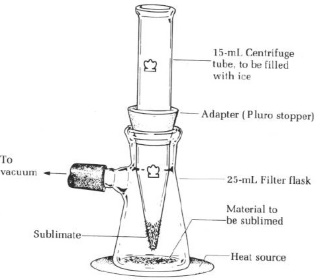
Trechtermethode |
|
|
 |
|
Erlenmeyer methode |
|
|
 |
| Microschaal sublimatie | |
|
 |
|
|
|
|
Objectglas methode |
|
|
 |
Resultaat:
|
Trechtermethode |
||
  |
||
| In eerste instantie ziet men wat condensvorming vervolgens sublimatie van ammoniumchloride. |
 |
|
| Erlenmeyer methode | ||
 |
 |
|
|
Wederom, ziet men in eerste instantie wat condensvorming en vervolgens de sublimatie van ammoniumchloride. |
 |
|
| Microschaal sublimatie | ||
|
Wederom, ziet men in eerste instantie wat condensvorming en vervolgens de sublimatie van ammoniumchloride. |
 |
|
 |
 |
|
| Detailopname | ||
 |
||
| Objectglas methode | ||
|
Wederom ziet men eerst water verdampen. Vervolgens ontstaat een witte neerslag op het bovenset objectglas. |
 |
|
|
Onder de microscoop ziet men geen duidelijke kristallen. |
 |
|
Discussie:
| Sublimatie is het natuurkundige verschijnsel dat bepaalde stoffen onder bepaalde omstandigheden (temperatuur) van een gasvormige toestand direct over gaan tot vaste stof of visa-versa. De vloeibare fase wordt dus overgeslagen. |
|
|
| Er zijn meer stoffen die bij verwarming direct vanuit de vaste stof in dampvorm overgaan. In contact met een koud voorwerp slaan dergelijke stoffen in kristallijne vorm daarop neer. Zwavel, jodium, kamfer, coffeďne, ascorbinezuur en benzoëzuur zijn enkele willekeurig gekozen voorbeelden van dergelijke stoffen. Indien een monster dat dergelijke stoffen bevat in een reageerbuis voorzichtig verwarmd wordt, dan ziet men de betreffende stoffen vaak in het koude gedeelte van de reageerbuis in kristallijne vorm neerslaan. Sublimatie kan men ook gebruiken om dergelijke stoffen te zuiveren. |
Voor mij was dit experiment een exercitie om met verschillende sublimatie methodes te experimenteren. Hierbij lijkt de microschaal methode de beste resultaten te leveren. Ik vraag me ondertussen wel af of ik het niet beter was geweest om deze experimenten met met een andere verbinding dan salmiak uit te voeren. |
Conclusies:
|
Literatuur:
|
Relevante websites: Andere relevante websites: |
Opmerkingen:
|
Achtergrondinformatie:
|
Fase-overgangen |
| Verschillende fases kunnen naast elkaar bestaan in een systeem. Welke dat zijn is afhankelijk van temperatuur, druk en samenstelling van de diverse fases. Via de grensvlakken tussen de fasen worden voortdurend moleculen uitgewisseld. Als een systeem in (een dynamisch) evenwicht is dan vindt er netto gezien geen stoftransport plaats (gemiddeld in de tijd gezien gaat er evenveel van de ene fase naar de andere fase). Als er geen evenwicht heerst, treedt er net zolang stoftransport op totdat er een stabiele toestand wordt bereikt. Hiermee veranderen dus hoeveelheden en samenstelling van de fases. Als een systeem in een stabiele toestand verkeert, is het aantal fases af te leiden uit de fasenregel van Gibbs: Het aantal vrijheidsgraden wordt gegeven door: F = 2 + C - P (2 wordt gegeven door T en P, C is het aantal componenten en P het aantal fasen). Voor een een componentsysteem (unair) is F dan maximaal 2 en voor een twee componenten systeem is F dan maximaal 3. Zo is dus het driefasesysteem ijs/water/damp alleen dan stabiel als dampdruk en temperatuur een bepaalde waarde hebben omdat F gelijk is aan 0. --> F = 2 + 1 - 3 = 0. Een faseovergang gaat altijd gepaard met veranderingen in een van de toestandsgrootheden van het systeem. |
|
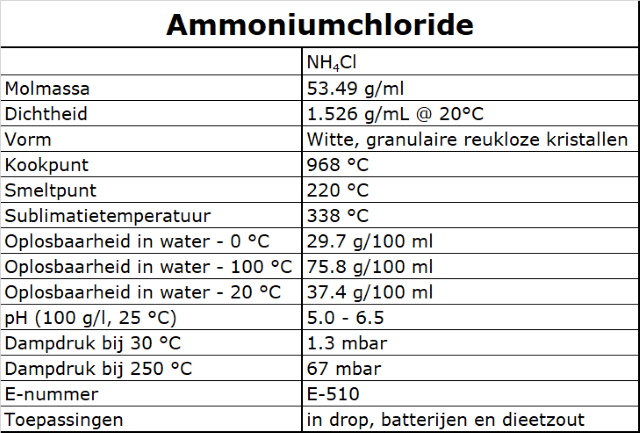
SALMIAK |
| Salmiak: Letterlijk “Ammonszout”, is
de gezochte term de veel gebruikte naam voor de chemische verbinding
ammoniumchloride, NH4Cl, die wordt verkregen door ammoniakgas in
zoutzuur te leiden. Komt in de natuur voor in vulkanische gebieden als
een aan Haliet verwant mineraal; ontstaat ook als bijproduct bij de
sodabereiding volgens het solvayproces.
Het kan bereid worden door gefractioneerde kristallisatie uit een oplossing bevattende ammoniumsulfaat and keukenzout of ammoniumcarbonaat en calciumchloride. Zuiver materiaal kan rechtstreeks gemaakt worden door de gasfase reactie van ammonia en zoutzuur. |
 |
05/05/2020