Experimenteren
met gist


|
Experimenteren
met gist |
 |

|
Datum: November 2021
Inleiding:
| Een herhaling van een eerder
uitgevoerd experiment met uitbreidingen en moderner apparatuur. |
Materiaal:
|
|
 CMA Coachlab |
 Druksensor |
 Temperatuursensor |
|
 Microschaal experimenteer kit |
 Zandbad verwarmer |
Uitvoering:
| Gist suspensie | ||
|
 |
|
| Microscopisch onderzoek |
||
|
||
| Fermentatie met het toestel van Einhorn en met een
ballon en erlenmeyer |
||
Toestel van
Einhorn
"Ballon fermentatie"
|
 |
|
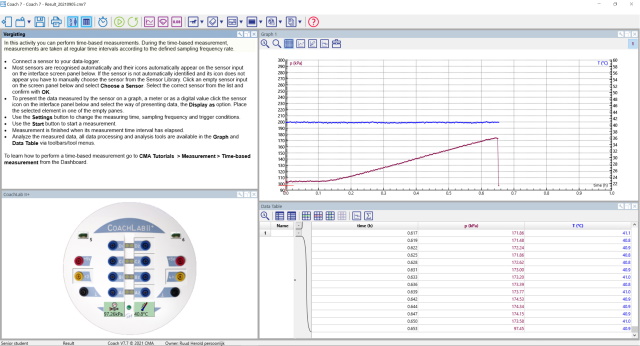
| Coachlab experimenten |
||
|
 |
|
|
 |
|
 |
||
| CO2 aantonen | ||
|
|
|
| Destillatie van suiker/gist oplossing | ||
|
 |
|
| Gistcellen tellen met de hemocytometer | ||
|
 |
|
 |
||
 |
 |
|
Resultaten en discussie:
| Lichtmicroscoop | |||
| Objectief: Euromex Phase DM 60X 0.40 DIN | |||
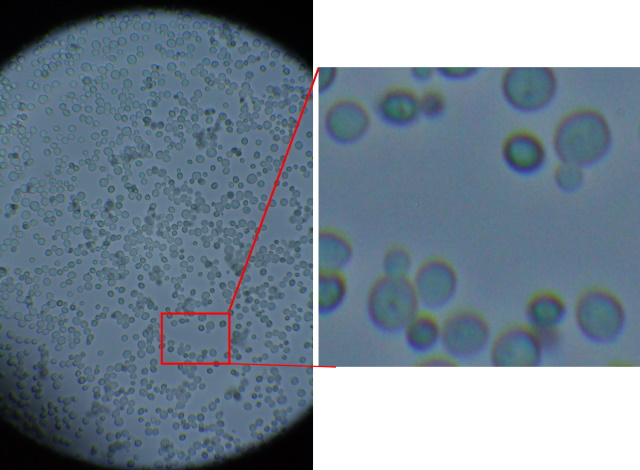 Gitcellen onder de microscoop. In de zoom kan men gistcellen zijn die aan het delen zijn. Met methyleenblauw gekleurde gistcellen. Levende gistcellen zijn levend, blauwgekleurde zijn dood. Een levende eencellige zoals gist breekt het methyleenblauw af door een reactie met een proton als het opgenomen wordt en zal daarom niet blauw kleuren. |
|||
| Gistsoorten vormen een zeer ongewone familie der fungi. De meeste bestaan uit afzonderlijke bolvormige cellen. Bij de gisten omsluit een dunne celwand het protoplasma, in het midden waarvan zich een vacuole bevindt. Een speciaal protoplasmakorreltje, de nucleolus, is hieraan bevestigd. Beide delen samen vormen de kern. In het protoplasma liggen korreltjes glycogeen en ander reservevoedsel. De cellen planten zich voort door spruiting of knopvorming, waarbij een uitstulping van de cel groter wordt en ten slotte als een onafhankelijke cel van de ouderplant wordt afgesnoerd. Als de knopvorming snel plaatsvindt, laten de afzonderlijke cellen niet direct los en het gevolg is dat men soms groepjes aan elkaar vastzittende cellen kan zien. | |||
| Resultaat Toestel van Einhorn en Erlenmeyer ballon na 24 uur | |||
 |
|||
 |
 |
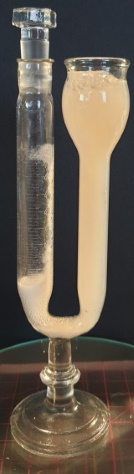 |

Na 104 minuten kan men echter al CO2 zien doorslippen. |
| 0 min, 0
% |
5 min, 0.05 % | 104 min, 1 % |
|
 |
 |
Ik heb dit experiment herhaald met een sucrose oplossing van 1 %. De saccharometer geeft na enige tijd 0.2 % aan. Nu moet ik toegeven dat ik niet exact het voorschrift volg. Ik laat deze nl. bij kamertemperatuur staan en plaats deze niet in een stoof om de oplossing the conditioneren. | |
| Beide experimenten laten zien dat er een gas gevormd
wordt.
Ook in de aantoningsreactie laat de belletjesvorming zien dat er een gas gevormd wordt. Dat we met inderdaad met CO2 te maken hebben wordt aangetoond door wat gevormd gas door een kalkwater oplossing te leiden. De oplossing van kalkwater wordt troebel hetgeen de aantoningsreactie voor CO2 is volgens: |
 |
||
| Destillatie van suiker/gist oplossing | |||
| Ik vroeg me af of ik wat
alcohol kon overdestilleren. De temperatuur stopte echter pas bij
95 °C en de druppel die ik overgedestilleerd heb kon ik niet
aansteken hetgeen aangeeft dat het een waterdruppel was. Het
overdestilleren van alcohol i(kookpunt ca. 78 °C) s dus niet
gelukt.
|
 |
||
| Coachlab experimenten | |||
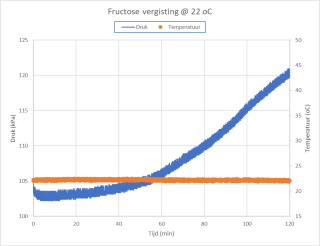
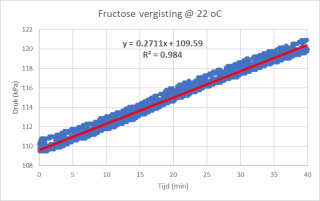
Verwerking
temperatuur data
|
 |
||
|
 |
||
 4 4
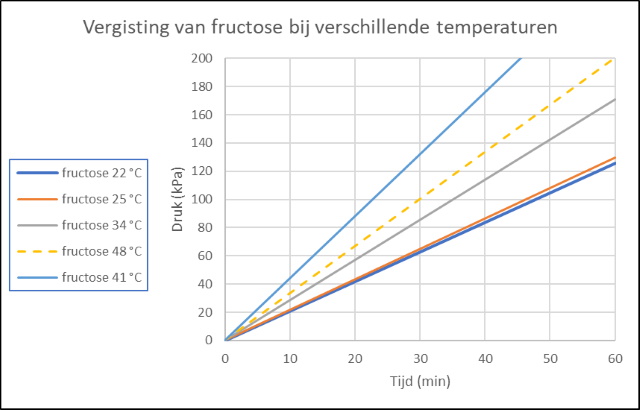
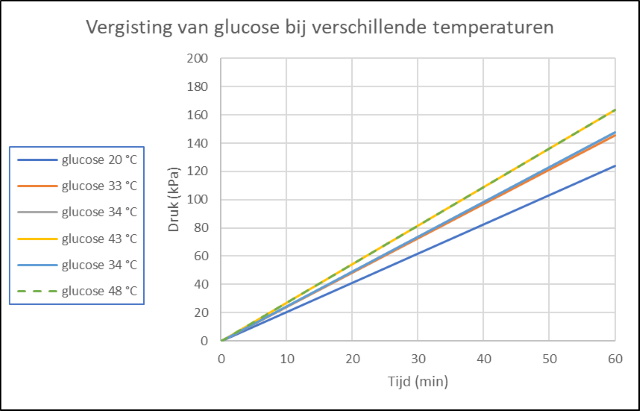
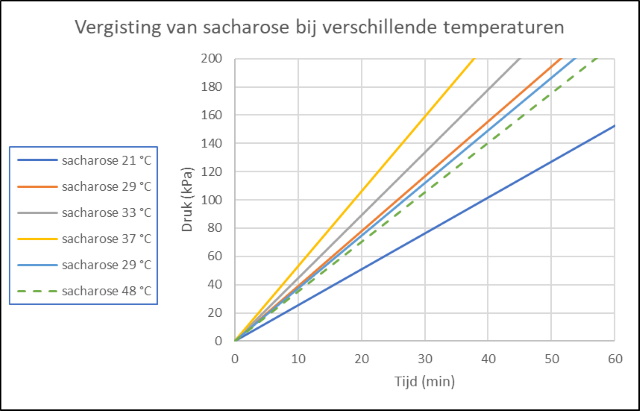
De in de gist aanwezige enzymen kunnen bepaalde suikers vergisten tot ethanol. Bij de gisting van gewone suiker heeft men te maken met een proces dat opgebouwd is uit twee stappen: 1. De suiker wordt gehydrolyseerd door de in de gist aanwezige enzymen tot glucose en fructose. Reactie : C12H22O11 +
H2O -----> 2C6H12O6 (glucose/fructose) 2. Glucose en fructose worden dan door de in de gist aanwezige enzymen omgezet in ethanol en CO2. Reactie : C6H12O6 -----> 2C2H5OH + 2CO2 De netto reactie wordt dan: C12H22O11 + H2O -----> 4C2H5OH + 4CO2 De toename van de hellingshoek bij oplopende temperatuur geeft aan dat de reactie sneller verloopt bij toenemende temperatuur (kinetiek wordt sneller, zie Achtergrondinformatie). Volgens de literatuur zou de
fermentatie snelheid stijgen bij temperaturen van 10 to 40 °C
en daarboven weer afnemen. Dat kunnen we inderdaad in
bovenstaande en onderstaande grafieken waarnemen. De vergistings snelheid
is lager of neemt niet meer toe bij een temperatuur van 48 °C
(gestippelde lijn). Bij te hoge temperatuur denatureren de
vergistingsenzymen (invertase of sucrase) en verliezen dan hun
katalytische aktiviteit. |
|||
 |
|||
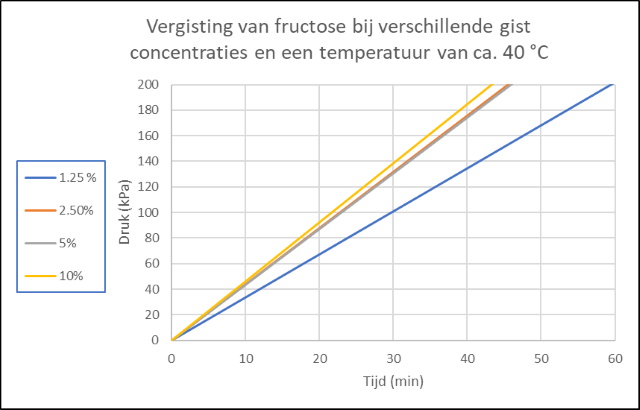
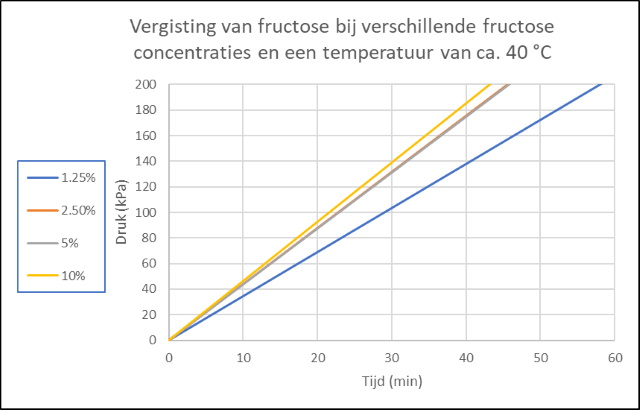
 Daarnaast hebben we voor fructose onderzocht of we een verschil kunnen waarnemen bij een variatie in suiker (in dit geval fructose) en gist concentraties. Hierbij zou een variatie in de gist concentratie overeenkomen met een variatie in enzymconcentratie. Onderstaande grafieken zijn nagenoeg identiek waardoor ik me na de dataverwerking afvroeg of ik een fout heb gemaakt bij het verzamelen en verwerken van de data. Voor zover ik het nog kan nagaan niet. Volgens de MM-kinetiek (zie achtergrondinformatie) heeft de enzym concentratie (gist) wel degelijk invloed op de reactiesnelheid en dat zien we in de onderste grafiek. |
|||
 |
|||
 |
|||
Gistcellen tellen met de hemocytometer |
| De hemocytometer wordt normaal gebruikt om bloedcellen te tellen maar in de vergistingsindutrie wordt deze ook wel gebruikt om m.b.v. methyleenblauwkleuring de verhouding tussen levende en dode cellen te bepalen. Zoals men in onderstaande foto kan zien zijn er meer zeer weinig dode cellen in het monster, 105 cellen in het kwadrant waarvan 6 blauwgekleurd. |
|
|
Literatuur:
Relevante websites: Minder relevante websites: |
||||||||
| Opmerkingen: |
||||||||
|
||||||||
Achtergrondinformatie:
|
||||||||
| Gisten |
||||||||
| Gisten zijn eencellige
micro-organismen met een grootte van circa 0,005-0,020 mm. Anders
dan bacteriën hebben gistcellen hun DNA in de celkern opgeborgen;
dat hebben zij gemeen met planten, dieren en mensen, waardoor zij
ingedeeld zijn bij de eukaryote organismen. Al vele duizenden jaren spelen gisten een belangrijke rol in het leven van de mens. De oudst bekende vorm van gistgebruik is de spontane omzetting van granen in bier en van druiven in wijn. Daarnaast wordt gist al eeuwen ingezet voor het laten rijzen van brooddeeg; aanvankelijk werd hiervoor de gist gebruikt die overbleef na de biergisting, maar sinds het eind van de negentiende eeuw wordt bakkersgist in toenemende mate gekweekt. Gist wordt ook gegeten. Als vitaminesupplement zijn er gisttabletten en als broodbeleg is er gistpasta(marmiet) te koop. Gist in de vorm van gistextract wordt als hartige smaakstof toegevoegd aan veel voedingsmiddelen, vooral aan soepen en sauzen. Dankzij het onderzoek van Louis Pasteur (1822-1895) werd duidelijk dat tijdens de wijngisting een toename optrad van het gewicht van de gist die gekoppeld was aan een toename van de hoeveelheid geproduceerde koolstofdioxide. Hieruit concludeerde hij dat er een chemische omzetting plaats vond. Verder onderzoek toonde aan dat gistcellen verantwoordelijk zijn voor de omzetting van suikers in alcohol en koolstofdioxide. Tevens bleken extracten van gistcellen ook andere chemische reacties te katalyseren. De hiervoor verantwoordelijke stoffen werden enzymen Genoemd, wat in het Grieks "in gist" betekent. Alle tot nu toe bekende gistsoorten zijn in staat om tenminste één suiker, bijvoorbeeld glucose of fructose, te gebruiken als enige bron van koolstof en energie. In aanwezigheid van zuurstof, dus bij de dissimilatie van de gist worden de suikers geheel omgezet in water en koolstofdioxide. Er wordt zoveel energie geproduceerd dat de gistcellen zich snel kunnen vermeerderen. Bij de alcoholische vergisting worden de gistcellen bij afwezigheid van zuurstof gedwongen om de suikers maar gedeeltelijk af te breken om in hun energiebehoefte te voorzien, dit levert echter veel minder energie op, als bijproducten ontstaan alcohol en CO2. Ook bij het broodbakken treedt een alcoholvergisting op. |
||||||||
| Enzymkinetiek | ||||||||
|
De vergistingsreactie verloopt aangezien er enzymen aangemaakt worden die ervoor zorgen dat de reacties kunnen verlopen. Een enzym is een eiwit met katalytische eigenschappen, vanwege hun vermogen om specifieke bindingen te activeren (de activeringsenergie wordt verlaagd).
Een enzym heeft naast een eiwitgedeelte (het apo-enzym) vaak nog een andere bouwsteen (de cofactor) nodig voor de katalyserende functie. Het geheel noemt men holo-enzym. Als cofactor kunnen optreden metaal-ionen (bv Ca2+) of een complex organisch molecuul dat als coenzym functioneert bv NADH De enzymkinetiek gedraagt zich niet wezenlijk anders dan de normale chemische kinetiek. Vaak heeft men te maken met pseudo-1ste-orde kinetiek (bv als in een 2de orde reactie een de concentraties zeer hoog is en de andere concentratie zeer laag). In een 1ste orde reactie is de reactiesnelheid evenredig met de concentratie van een reactant. Voor de reactie: S --> P Geldt dan:
Hieruit volgt ook dat de concentratie van P gemakkelijk te berekenen is volgens: [P] = [S]0 – [S] (waarin [S]0 de concentratie van S op tijdstip t=0 is). Het concentratieverloop is grafisch weergegeven in onderstaande figuur.
Bij een enzymatische bepaling laat men het enzym enige tijd inwerken op het substraat en bepaald men de substraat (S) of product (P) concentratie op verschillende tijdstippen (of continue). De kromme die het verband weergeeft tussen bv de hoeveelheid omgezet substraat (de conversie) en de tijd, noemt men de progress-curve.
We kunnen in de progress-curve zien dat de conversie van S steeds verder van de raaklijn afwijkt. Voor deze afwijking zijn verschillende oorzaken mogelijk:
Om van deze afwijking geen last te hebben moet men dus meten rond t=0. Het effect van de verschillende enzymconcentraties kan nog duidelijker zichtbaar gemaakt worden door de reactiesnelheid (de omgezette hoeveelheid per tijdseenheid) als functie van de enzymconcentratie uit te zetten. Door het maken van zulk een curve kan men zien dat alleen op t=0 er een lineair verband bestaat tussen de enzymwerking (reactiesnelheid) en enzymhoeveelheid. De juiste reactiesnelheid wordt dus gevonden door op t=0 de raaklijn aan de progress-curve te trekken. Deze reactiesnelheid noemt men de initial velocity (v0). Er zijn een aantal factoren die van invloed zijn op de reactiesnelheid (initial velocity):
In 1913 ontwikkelden L.Michaelis en M.Menten (MM) een algemene theorie over de werking van enzymen. Briggs en Haldane breidden deze theorie later uit. Deze uitbreiding staat bekend onder de naam steady-state theorie. De MM theorie vormt de basis van de kwantitatieve analyse van alle aspecten van enzymkinetiek en inhibitie en is het best ontwikkeld voor een (1) substraat. De MM theorie gaat er van uit dat een enzym E met het substraat S een enzymsubstraat complex ES vormt dat in een tweede stap uiteenvalt in vrij enzym E en product P (beide reacties zijn reversibel). De MM vergelijking afgeleid volgens de steady-state theorie geeft het mathematische verband tussen de initiële snelheid (initial velocity), de concentratie S en enkele karakteristieke kenmerken van een enzym. Reactie:
Symbolen:
Volgens de steady state theorie is de vormingssnelheid van ES gelijk aan de ontledingssnelheid. De vormingssnelheid van ES: Hier verwaarlozen we de terugvorming uit P aangezien op t=0 geldt P=0. De ontledingssnelheid van ES: (1) = (2) ==> Dus: De initial velocity (reactiesnelheid op t=0) wordt bepaald door de productvorming uit ES:
(4) in (5) geeft: De maximale reactiesnelheid (Vmax, S -->
De constante (7) en (8) in (6) geeft de Michaelis-Menten vergelijking:
Consequenties:
De vorm waarin de MM vergelijking is gegoten is onhandig om uit de experimentele gegevens KM en Vmax te bepalen. Daarom heeft men deze vergelijking getransformeerd naar een lineaire vergelijking (door de reciproke te nemen) waarmee men de Lineweaver-Burk plot kan verkrijgen (die een rechte lijn geeft als men 1/v0 t.o.v. 1/s uitzet).
Helling = KM/Vmax Snijpunt y-as = 1/Vmax Snijpunt x-as = -1/KM |
||||||||
| Saccharometer Bron: L. Halleman; "Klinische chemie und Mikroskopie"; 1947; 5de druk; Thieme; p. 142,143. |
||||||||
 |
||||||||
 |
||||||||