Gefractioneerde destillatie gevolgd door bepaling van het alcoholgehalte (CoachLab)


|
Gefractioneerde destillatie gevolgd door bepaling van het alcoholgehalte (CoachLab) |

|

|
Datum: December 2023
Inleiding:
| Ik heb al eerder destillatie experimenten met de microschaalkit uitgevoerd maar was nooit echt tevreden omdat we maar met een zeer beperkt aantal schotels te maken hadden. De tip om er eens een fractionerings kolom te maken door deze met kopergaas te vullen (meer schotels) leek me de moeite waard om eens te proberen.. |
Materiaal:
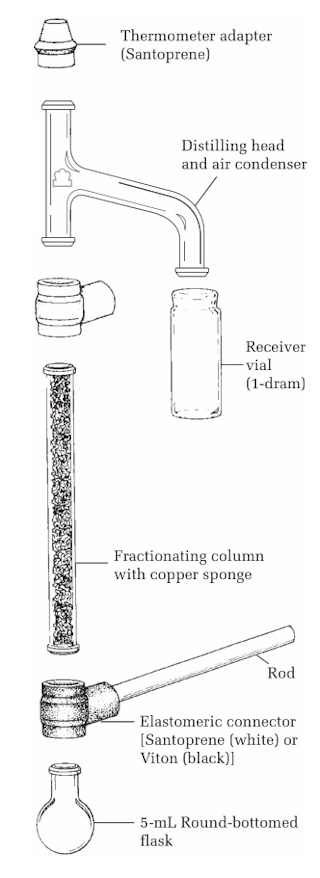
Microschaal kit met:
|
|
|
|
|
|
|
|
Uitvoering:
| Vullen van de kolom met kopergaas | |
|
|
 |
 |
|
Destillatie van rode wijn |
|
|
 |
 |
|
|
Bepalen van het alcoholgehalte |
|
Maak de volgende stockoplossingen in water:
|
|
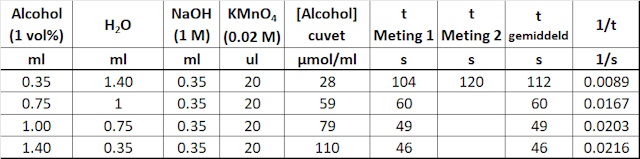
Data voor calibratielijn:
|
|
|
|
|
|
|
Meten van het monster
Meten van referentiemonsters:
|
|
 |
|
 |
|
Data analyse
|
|
| Wijn en jenever: | |
 |
 
|
Resultaten en discussie:
| Destillatie van rode wijn | |
|
Onderstaande foto laat de destillatie op microschaal in actie zien. Het experiment is dan al een aantal malen herhaald en er zijn ook een aantal alcoholische fracties verzameld. |
|
 |
|
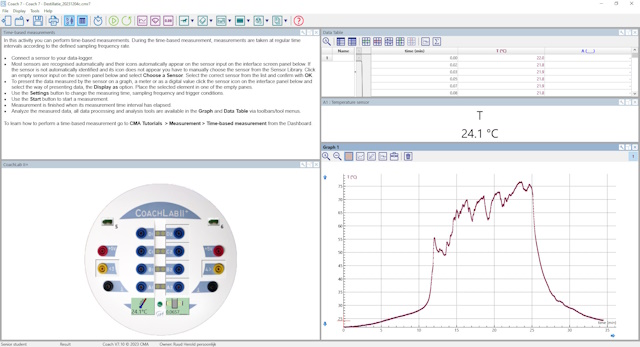
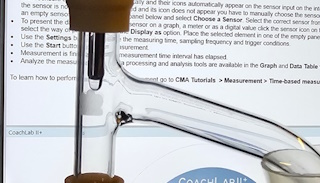
| Onderstaande screenschot is van een CoachLab experiment waarbij de grafiek eruit gelicht is. | |
 |
|
 |
|
Deze grafiek is typerend voor de uitgevoerde experimenten maar behoeft enige
toelichting.
|
|
 |
 |
| Aantonen van alcohol m.b.v. de vlamtest | |
|
YouTube link: Vlamtest | |
| De kleur van de vlammen kan soms informatie opleveren. De kleur van een ethanol verbrandingsvlam is nagenoeg kleurloos. Methanoldampen verbranden met een blauwige vlam. Een vlamtest kan alleen werken als het alcohol gehalte boven de 30% is. | |
| Bepalen van het alcoholgehalte | |
|
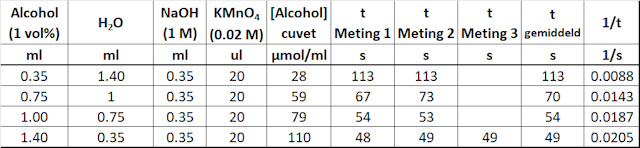
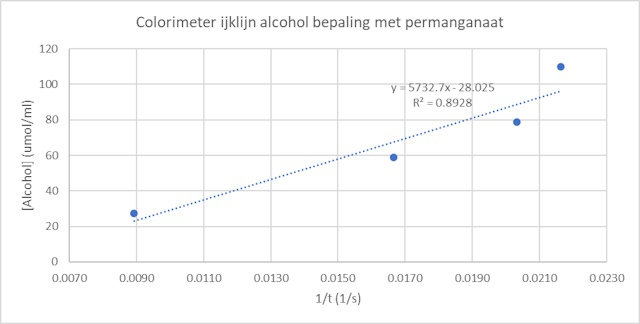
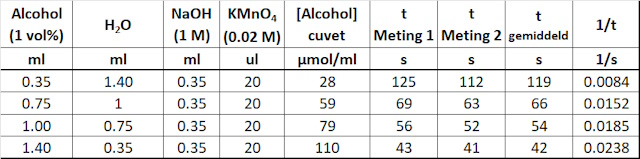
In onderstaande tabel zijn de meetresultaten
samengevat die de basis vormen voor de ijklijn zoals die uitgezet is in de
grafiek. De berekening voor de ijklijn verloopt als volgt. Uitgaande van een
dichtheid voor ethanol van 0.8 g/ml en een molmassa dan berekenen we voor
een oplossing van 1 vol%: Uitgaande van een dichtheid van 0.8 g/ml en corrigerende voor een gehalte van 96% EtOH dan berekenen we dat 1 ml 0.768 g EtOH/ml bevat. Met een molmassa van 46.068 g/ml berekenen we een concentratie van 16.671 mmol/ml. Deze oplossing verdunnen we 100x (1 ml in 100 ml water) hetgeen resulteert in een concentratie van 166.71 µmol EtOH/ml. De hoeveelheid 1vol% alcohol oplossing die we bewerking hebben genomen vermenigvuldigd met 166.71 µmol/ml gedeeld door het cuvet eindvolume van 2.12 ml geeft de concentratie ethanol in de cuvet die we gebruiken voor het bepalen van de ijklijn. |
|
 |
|
 |
|
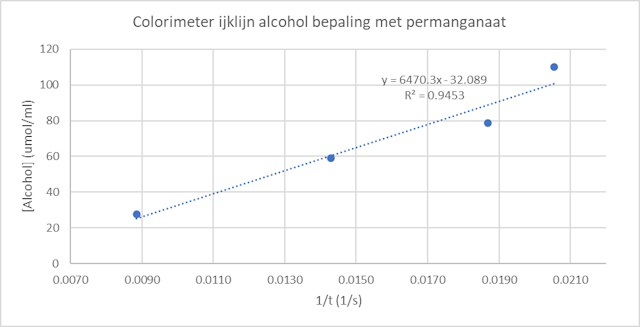
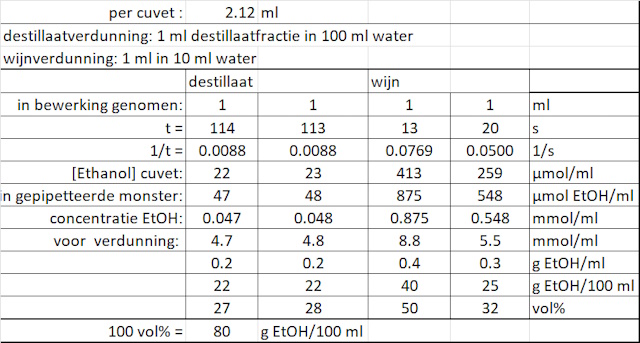
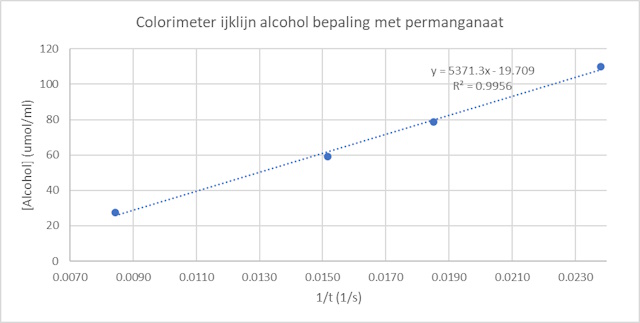
| De ijklijn gebruiken we om de alcohol concentratie in het oorspronkelijke oplossing te berekenen. De berekening is samengevat in onderstaande tabel. | |
 |
|
| Deze gehaltes waarbij 1 ml monster in bewerking is genomen komen gevoelsmatig laag over maar zijn voldoende hoog om de vlamtest succesvol uit te voeren. Dat geld echter niet voor het monster waarbij maar 0.75 ml in bewerking is genomen, het gehalte is te laag voor een succesvolle vlamtest. Het probleem waarmee we geconfronteerd worden is dat we geen referentiemonster in bewerking hebben genomen en dus de berekende gehaltes niet kunnen vergelijken met een monster waarvan de concentratie bekend is. In eerste instantie had ik alleen de rode wijn tot mijn beschikking die ik daarom geprobeerd heb als referentiemonster te gebruiken. Het probleem is dat deze wijn niet kleurloos is en de rode kleurstof mogelijk de meting beďnvloedt. Besloten werd om het alsnog te proberen omdat het monster verdund zou worden. | |
 |
|
 |
|
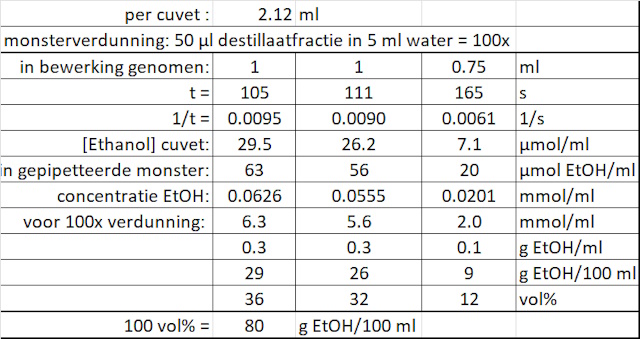
| De meetresultaten en berekeningen van de monsters zijn samengevat in onderstaande tabel. | |
 |
|
|
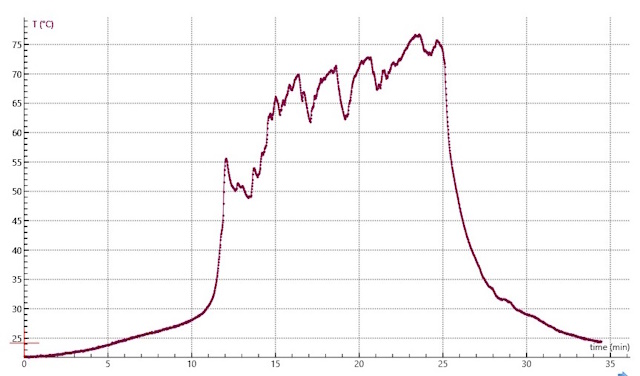
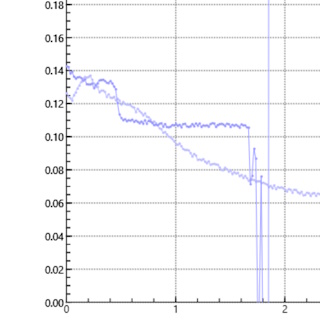
Met de rode wijn zijn ondanks de verdunning geen goede metingen uit te
voeren. Dat is te zien aan de berekeningen (te hoog alcoholgehalte) maar ook goed zichtbaar tijdens de meting zelf. Men verkrijgt niet de
benodigde curves (zie nevenstaande grafiek) waarin men duidelijk een maximum
kan bepalen. Het maximum kan men alleen maar afschatten. De meetresultaten voor het destillaat waarbij 1 ml in bewerking is genomen komen grofweg overeen met het eerder behaalde resultaat. |
 |
| Het moge duidelijk zijn dat een minimale eis die men aan een referentiemonster stelt is dat deze kleurloos moet zijn. Voor dat doel werd daarom een mini-flesje jenever gekocht. | |
 |
|
 |
|
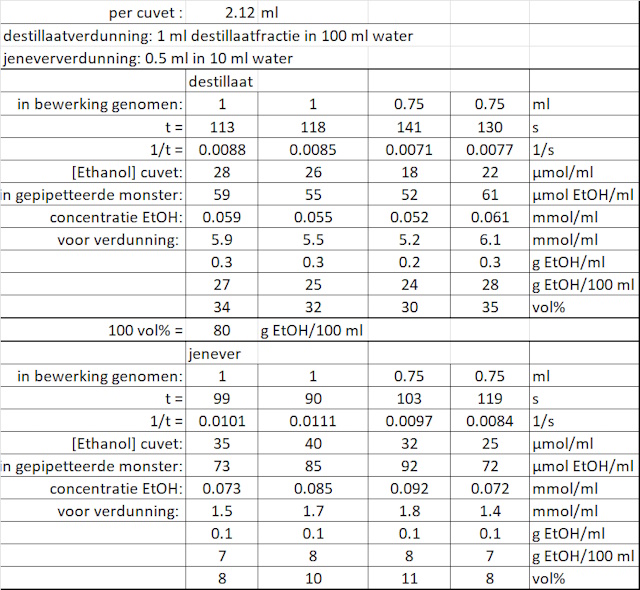
| De meetresultaten en berekeningen van de monsters zijn samengevat in onderstaande tabel. | |
 |
|
| De resultaten voor het destillaatmonster zijn nu in lijn met eerder behaalde resultaten. Dat geld echter niet voor het jenevermonster. Volgens het etiket is het gehalte alcohol in de jenever 35%. Het meetresultaat is echter een factor 3 lager. Ervan uitgaande dat er geen rekenfouten gemaakt zijn impliceert dit resultaat dat het destillaat ook een veel hogere alcohol concentratie heeft dan berekend. Op zich zou men dit ook verwachten omdat, op basis van de visuele observaties, men alleen vluchtige stoffen heeft overgedestilleerd en gestopt is voor er water werd overgedestilleerd. Op basis van deze resultaten kan men eigenlijk alleen maar concluderen dat de alcoholbepalingsmethode niet erg betrouwbaar is. De enige manier om hier zekerheid over te verkrijgen is om een betrouwbaarder alcohol bepalingsmethode te gebruiken (bv gaschromatografie). Dergelijke apparatuur heb ik echter niet tot mijn beschikking. | |
Methodologie basis :
| Destillatie is een scheidingstechniek, waarbij meerdere stoffen van elkaar worden gescheiden, op basis van verschil in kookpunten. Destillatie is een techniek die veel gebruikt wordt en niet alleen in het laboratorium. Vooral in de chemische en petrochemische industrie het proces op grote schal wordt toegepast. De manier waarop we destillatie in dit experiment hebben toegepast is een van de oudste en bekendste, het verkrijgen van sterk alcoholische dranken door destillatie van wijn of bier. Volgens de literatuur kun je alcohol/water mengsels niet helemaal scheiden door destillatie aangezien ze een azeotropisch mengsel vormen (Zie achtergrondinformatie). Het azeotropisch mengsel heeft een kookpunt van 78.15 °C (ethanol kookt bij 78.3 °C en water bij 100 °C) en bevat dan 4 wt% water. | |
| Voor de bepaling van het alcoholgehalte maken we gebruiken van de redox-reactie van alcohol met het permanganaation, MnO4 - , in een alkalisch milieu. De kleurverandering van paars/violet naar paars/groen naar groen geeft aan in hoeverre het MnO4- (paars) is omgezet naar MnO42-(groen). Het ethanol, CH3CH2OH, wordt omgezet in ethanal, CH3CHO, een vergelijkbare omzetting vindt plaats in je lichaam. | |
| De eerste reactie vormt het aldehyde: | |
|
|
|
| In de tweede reactie reageert het aldehyde verder tot azijnzuur: | |
|
|
|
| Onderstaande video laat de kleurverandering zien. Als men langer wacht wordt de oplossing weer wat bruiniger en ontstaat de vaste stof bruinsteen (MnO2). | |
|
YouTube link: Kleurverandering | |
Conclusies:
|
Opmerkingen:
|
Literatuur:
Relevante websites:
Minder relevante websites: |
|
Achtergrondinformatie: |
|
| De scheiding van een homogeen vloeistofmengsel door destillatie berust op het verschil in vluchtigheid van de bestanddelen. Dit laat zich het beste illustreren mbv een fasediagram waarbij het verband gegeven wordt tussen de temperatuur en de concentraties in de vloeistof- en dampfase voor een bepaalde totaaldruk. De kookpunten van de zuivere stoffen zijn A en B. | |
|
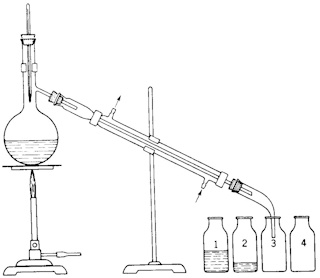
De curve AFDB geeft de kookpunten aan voor vloeibare mengsels van A en B (kookpuntslijn). De curve AEB geeft de samenstelling van de damp, die met de vloeistof bij een gegeven temperatuur in evenwicht is (dauwpuntslijn). Bij verwarming van een vloeistofmengsel C zal dit bij D beginnen te koken. De damp, die ontstaat heeft de samenstelling E en bevat meer van de vluchtige component dan de kokende vloeistof D. Koelt men deze damp af dan verkrijgt men destillaat F, waarin de concentratie van de meest vluchtige component groter is dan in het oorspronkelijke vloeistofmengsel C. De samenstelling van de kokende vloeistof zal tijdens de destillatie veranderen, hetgeen met een stijging van het kookpunt en een geleidelijke verandering van de samenstelling van de coëxisterende damp gepaard zal gaan. Men kan derhalve het destillaat in verschillende fracties opvangen en op deze wijze het meer vluchtige bestanddeel van het minder vluchtige scheiden. Deze manier van werken noemt men een gefractioneerde destillatie (Zie de tekening hier beneden). |
|
| Bij de zuivering door destillatie wordt een verbinding in dampvorm gebracht; de gevormde damp wordt daarna op een andere plaats gecondenseerd. Het kookpunt van een verbinding bij atmosferische druk is hoger dan het kookpunt bij een verminderde druk. Verbindingen, die bij verhoogde temperatuur snel ontleden, worden daarom bij voorkeur gezuiverd door destillatie onder verminderde druk. Indien de er een mengsel samenstelling is waarbij het kookpunt van dat mengsel beneden of boven het kookpunt van de individuele componenten ligt spreken we van een azeotropische samenstelling; bij deze samenstelling heeft de damp dezelfde samenstelling als de kokende vloeistof. Dergelijke mengsels kan men door destillatie niet verder scheiden. |
 |
|
Microschaal / microdestillatie set in
koffer. De set omvat de volgende onderdelen: |
|
|
|
|
|
|
15/01/2024