

| Conductometrische titratie van een HY zeoliet (Coachlab) |
 |
 |
Datum : februari 2006
Principe:
| Het aantal Bronsted zure sites bepalen van een
zeoliet m.b.v. een conductometrische titratie volgens de zuur-base reactie: NaOH + Y-H --> H2O + Y-Na |
Inleiding:
| In het verleden heb ik ooit eens het lespakket Experimenteren met zeolieten bij de stichting C3 besteld. Een van de zeolieten die daarin zit is HY, alleen niet in de zure vorm maar in de ammonium (NH4+) vorm. Je activeert een dergelijk zeoliet door hem bij een hoge temperatuur te calcineren waardoor NH3 afgesplitst wordt en het proton overblijft. Heb je eenmaal een zuur zeoliet dan is de vraag die je jezelf kunt stellen hoeveel Bronsted zure sites er in de zeoliet zitten. Een van de makkelijkste manieren om dat te bepalen is mbv een conductometrische titratie. Daarnaast vroeg ik me af of ik de energie die vrijkomt bij een neutralisatie reactie kon bepalen door te kijken of ik een temperatuurverandering kon meten tijdens de titratie. Om dat te bepalen heb ik de titratie ook in een 'calorimeter' uitgevoerd. |
Benodigd:
|
|
Werkwijze:
| Activeren van de zeoliet | |
| Aangezien ik geen mooie oven tot mijn beschikking om de zeoliet te activeren door verhitting heb ik een aantal grammen in een porseleinen schaaltje gedurende 1 uur verwarmd boven een spiritusbrander. M.b.v. een elektronische thermometer heb ik gecontroleerd of de temperatuur voldoende hoog was. Bij een temperatuur van 200 tot 400 oC wordt de zeoliet NH4Y omgezet in zeoliet HY. |  |
| Experiment 1 | |
|
|
|
|
| De thermocel (coffee-cup calorimeter) | |
|
De calorimeter is opgebouwd door twee plastic koffiebekers in elkaar te zetten. In een koffiebeker dekseltje maakt men vervolgens de gaten voor elektrodes en titratie slangetje.
|
|
| Experiment 2 | |
| Bouw de opstelling op zoals in nevenstaande foto is aangegeven, en voer vervolgens de titratie uit op exact dezelfde manier als in experiment 1 beschreven. |
|
| Exporteer de meetgegevens als DIF
file, importeer deze in Excel en analyseer de data.
Werk vervolgens de meetgegevens uit. |
|
|
|
|
| Er is een specifiek probleem met de gebruikte software. Men kan n.l. alleen een voorgeprogrammeerde temperatuursensor gebruiken en dat is een andere dan ikzelf tot mijn beschikking had. Dit betekent dat men een ijklijn moet maken om de gemeten temperatuur te converteren naar de werkelijke temperatuur. Hiervoor is een tweede (losse) temperatuursensor nodig. Warm een bekerglaasje met water op en laat het afkoelen. Meet regelmatig de temperatuur met de losse sensor en lees de Coachlab waarde op datzelfde moment uit. Zet deze getallen tegen elkaar uit en gebruik de trendlijn voor de conversie. | 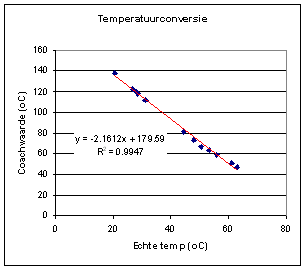 |
Meetresultaten:
| EXPERIMENT 1 | |
|
In de conductometrie is het gebruikelijk om
volume correctie toe te passen op de meetwaarde mbv de formule ((V+v)/V
waarin V is het oorspronkelijke volume en v het totaal toegevoegde volume).
Op deze manier compenseert men voor verdunningseffecten. In de grafiek
hiernaast is deze correctie toegepast.
Het equivalentiepunt berekenen we door raaklijnen voor en na het e.p. te trekken waarbij het e.p. zich op het snijpunt bevindt. In Excel kunnen we dit gemakkelijker doen door regressielijnen te trekken, de lijnvergelijkingen op te vragen en vervolgens het snijpunt te berekenen voor x. |
|
|
M.a.w.: => 90.672x + 4.3408 = 1898.7x -1575.7 => 1580.0408 = 1989.372x => x = 0.794 mmol NaOH We hadden 0.5 g zeoliet ingewogen. In de grafiek plotten we ook het gemeten temperatuurverloop. Excelsheet: Experiment 1 |
|
| EXPERIMENT 2 | |
|
Analoog aan Experiment 1 berekenen we het e.p.:
=> 112.19x + 5.2157 = 2191.6x -1645.1 We hadden 0.5 g zeoliet ingewogen. In de grafiek plotten we ook het gemeten temperatuurverloop. Excelsheet: Experiment 2 |
|
Discussie:
|
Vanwaar dit experiment. In het verleden heb ik zelf dit soort conductormetrische
titraties uitgevoerd (zie Crocker et al). Deze zeoliet heb ik ooit eens verkregen via de stichting
C3 als
onderdeel van een experimenteerpakket "Experimenteren met zeolieten".
Aangezien ik echter geen goede calcineeroven tot mijn beschikking had heb ik
nooit echt veel met dit experimenteerpakket gedaan, totdat ik bedacht dat ik mbv
een conductometrische titratie kon controleren of de activering gelukt was.
Met Coachlab heb ik de mogelijkheid om dit soort experimenten zelf uit te
voeren. Daarnaast vroeg ik me af of een thermometrische titratie ook uitvoerbaar
was op deze manier. Met de gedachte van "Meten is Weten" besloot ik
vervolgens om deze experimenten uit te voeren.
Activeren van de zeoliet Zeoliet Y wordt in de Na-vorm gesynthetiseerd. Om er een zure katalysator van te maken die H+ ionen in de plaats van de Na+-ionen bevat brengt men deze eerst in de NH4+ vorm door de Na+-ionen uit te wisselen met NH4+-ionen. Vervolgens verhit men de zeoliet op een temperatuur van 200-400 oC waarbij de NH4Y zeoliet wordt omgezet in de HY zeoliet volgens onderstaand reactieschema.
Bij het activeren door verwarmen op de spiritusbrander hebben we een temperatuur boven de 200 oC gemeten. Thermometrische titratie De temperatuurmetingen laten geen duidelijk meetbaar effect zien. De neutralisatiewarmte die bij een zuur-base titratie in water milieu wel meetbaar is kunnen we hier niet waarnemen. Waarschijnlijk wordt de neutralisatiewarmte geheel "geabsorbeerd" door het kristalrooster van de zeoliet. Conductometrische titratie In principe kun je dit experiment ook potentiometrisch uitvoeren door eerst de zure sites uit te wisselen mbv een natriumchloride oplossing, vervolgens de oplossing af te filtreren en het filtraat te titreren met loog. Aangezien een uitwisselingsreactie een evenwichtinstelling is het aanbevolen om de uitwisselingsstap 3* uit te voeren om er zeker van te zijn dat alle protonen uitgewisseld zijn met Na+. Dit "evenwichtsinstellingsprobleem" hebben we niet in een conductometrische titratie aangezien we de H3O+ ionen "in-situ" neutraliseren. Om de oplossing nu elektrisch neutraal te houden zal het Na+-ion zich aan de ionuitwisselingssite op zeoliet moeten hechten. De neutralisatiereactie is dus een extra drijvende kracht die ervoor zorgt dat het evenwicht geheel rechts licht. De relevante reacties kunnen we als volgt uitschrijven:
Het gemiddeld Bronsted zuurgehalte dat we op deze manier bepalen is: 1.5 mmol/g. Deze waarde ligt boven de waardes die gevonden zijn voor Mordenieten en ZSM-5 (Crocker et al). Voor die zeolieten zijn waardes van max 1 mmol/g gevonden. Dit getal word vnl bepaald door het Al-gehalte in de zeoliet die een maat is voor het aantal proton uitwisselingssites dat een zeoliet bezit (zie Achtergrondinformatie en Activering van een zeoliet). In het artikel van Coker et al worden vreemd genoeg geen uitwisselingswaardes vermeld alhoewel dit artikel experimenten beschrijft die betrekking hebben op uitwisselingsreacties. Jammer genoeg biedt Breck ook geen uitsluitsel in deze zaak aangezien deze de uitwisselingscapaciteit uitdrukt als functie van het aluminiumgehalte. Het aluminiumgehalte van de onderzochte zeoliet is ons echter niet bekend. |
||||||||||||
Conclusie:
|
Opmerkingen:
|
Literatuur:
Relevante websites: |
Achtergrondinformatie:
| Zeolieten |
|
| Zeolieten
zijn een groep mineralen waarvan het mineraal stilbiet in 1756 ontdekt
werd door Cronstedt. De naam zeoliet is afgeleid van het Griekse zeo
lithos, hetgeen komende/bruisende steen betekent. Op deze naam is men
gekomen omdat het bij verwarming tot 200 oC zichtbaar water
verliest.
Een zeoliet bestaat uit een
kristalrooster opgebouwd uit tetraŽders van SiO4 ent AlO4.
Op deze manier worden microporeuze kristallijne aluminosilicaten gevormd.
De bindingen van de zuurstofatomen in deze kristalstructuur worden gedeeld
waardoor een driedimensionaal netwerk ontstaat. De verschillende
stapelingen van tetraŽders zorgt voor allerlei verscheidene
structuren. |
|
| Deze zeolietstructuren hebben elk verschillende ordegroten poriŽn. De diameters van deze poriŽn komen overeen met de afmetingen van kleinere moleculen. Zeolieten worden daarom ook wel moleculaire zeven genoemd (molsieves). Omdat kleine moleculen in deze poriŽn kunnen passen heeft het zeoliet omkeerbare adsorptie- en desorptie- eigenschappen voor water en andere kleinere moleculen. Daarnaast kunnen zeolieten ook ionenwisselaar zijn voor positieve ionen. |
|
|
In
de proces en gasindustrie worden zeolieten gebruikt als droogmiddel om
gasstromen te drogen. Daarnaast worden zeolieten grootschalige toegepast als
katalysator. Een zeoliet dat in zijn zure vorm is gebracht kan gebruikt
worden voor het katalytisch kraken van lange koolstofketens in
raffinaderijen. Zeolieten worden zuur door de aanwezigheid van het
aluminium in het kristalrooster. De zeoliet wordt negatief geladen (Al3+
versus Si4+). Deze negatieve lading wordt vervolgens weer
gecompenseerd door de toevoeging van tegen-ionen, zoals natrium, die in de
poriŽn zullen gaan zitten. Als men protonen gebruikt als tegen-ion wordt
een zeoliet zuur. De zuurheid is gelokaliseerd in de zeoliet zelf. Met
zeolieten kan men op deze manier zure katalyse toepassen zonder de
oplossing werkelijk zuur te maken. Het vervangen van natriumionen door protonen gebeurt door eerst het zeoliet in contact te brengen met een overmaat van NH4NO3 oplossing. Bij een hoge overmaat NH4+ zal het overgrote deel van natriumionen uitgewisseld worden. Door dit enkele malen te herhalen kunnen uiteindelijk alle natriumionen vervangen worden. Door vervolgens de zeoliet op een temperatuur van 200-400 oC te verhitten wordt de NH4-zeoliet omgezet in een H-zeoliet door afsplitsing van NH3. Dit is ook de reden dat men bij voorkeur nitraten gebruikt aangezien de restanten die eventueel op het zeoliet achterblijven tijdens de calcinatie "afgebrand" worden (NO en NO2). Literatuur:
|
|
18-01-2017