Digitale
camera als colorimeter
(zetmeelgehalte in patat colorimetrisch
bepalen)


|
Digitale
camera als colorimeter |
 |
 |
Datum : maart 2008
Inleiding:
| Veel van de "gadgets" die we tegenwoordig tot onze beschikking hebben zijn ook geschikt om als analytisch meetinstrument te gebruiken. Een van die gadgets is de digitale camera die geschikt is om spectrofotometrisch gehaltes te bepalen. |
Principe:
| Het zetmeelgehalte in patat bepalen mbv jood en een digitale camera spectroscopisch bepalen. |
Benodigd:
|
|
Werkwijze:
|
Bereiding van de zetmeel stock oplossing (10.0 g/l):
Gebruik deze stockoplossing
om een verdunningsreeks te maken. |
|
|
Bereiding van de Jood
indicator oplossing: |
|
|
Bereiding ijklijn: Schud de stockoplossing goed voordat men gaat overbrengen in de buizen.
Voeg aan elke buis 8 ml joodoplossing
toe. |
|
Bereiding meetoplossing:
|
|
Meting:
|
|
Resultaten:
|
|
|
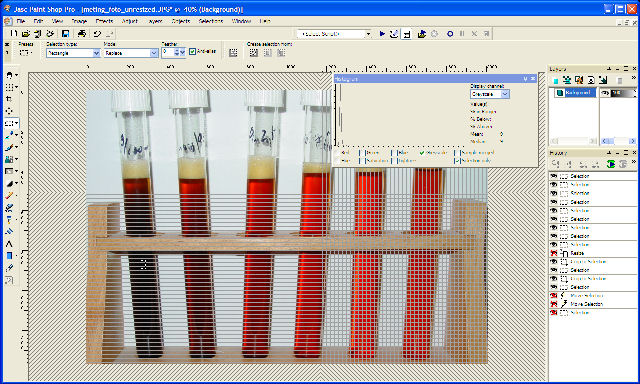
Onderstaande foto is voor de analyse gebruikt. |
|
|
|
|
|
|
 |
|
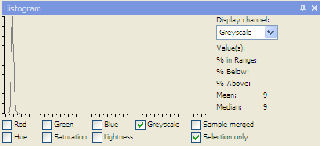
| 10 g/l = 9 |
 |
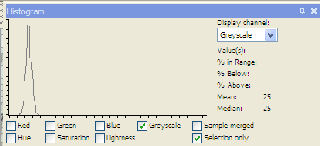
| 5 g/l = 25 |
 |
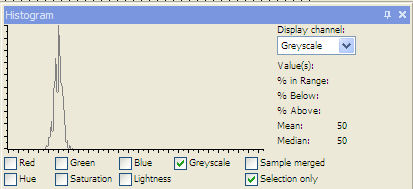
| 2.5 g/l = 50 |
 |
| 1.25 g/l = 79 |
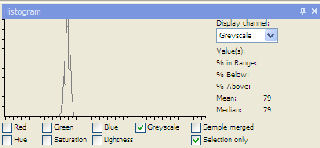 |
| blanco = 107 |
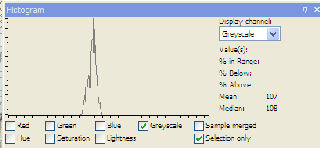 |
| monster = 85 |
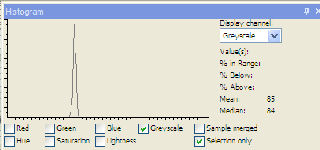 |
|
Zetten we nu de meetresultaten uit als functie van de concentratie dan verkrijgen we nevenstaande grafiek. We kunnen een paar conclusies trekken. De correlatie tussen meetwaarde en concentratie is niet lineair. Leggen we er een trendlijn over dan zien we dat we een goede correlatie krijgen mbv een logaritmische vergelijking. Voor concentratiebepalingen hebben we echter liever een lineaire vergelijking. Het gegeven dat we hier met een logaritmische vergelijking te maken hebben zou bij elke chemicus een lampje moeten laten branden nl dat van de Wet van Lambert-Beer. |
|
|
De hoeveelheid licht die een oplossing doorlaat (transmitteert) wordt uitgedrukt in de grootheid transmissie (T). Onder de transmissie (T) wordt verstaan het quotiŽnt - eventueel uitgedrukt in procenten - van de doorgelaten hoeveelheid licht (It) en de opvallende hoeveelheid licht (Io): Transmissie: T = It/Io ( * 100 = %T) Absorptie: A = 1-T = Ia/Io In de absorptiespectrometrie wordt, in plaats van met transmissie of met absorptie, met de grootheid extinctie (E, uitdoving) gewerkt (de negatieve logaritme van de transmissie). In formule (T uitgedrukt als quotiŽnt) : E = - log T = log 1/T = log 1 - log T In formule (T uitgedrukt in procenten) : E = - log T(%) = log 100(%)/T(%) = log 100(%) - log T(%) = 2 - log T(%) |
|
|
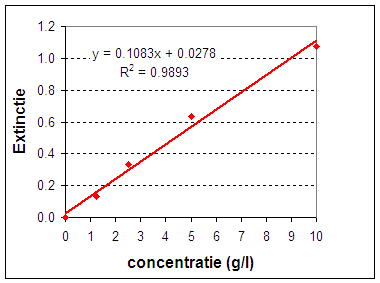
Hoe vertalen we nu bovenstaande theorie naar hetgeen we gemeten hebben. Dat kunnen we doen door gebruik te maken van de manier waarop een computer kleuren definieert nl. in getallen van 0 tot en met 255 (256 = hexadecimaal getal). In onze situatie met grijstinten vertalen we 255 als volkomen helder en 0 als volkomen donker. Dit betekent weer dat we de intensiteit % kunnen uitdrukken als transmissie (T) en deze weer omrekenen naar Extinctie. Op deze manier creŽren we een lineaire relatie tussen concentratie en meetwaarde zoals weergegeven in onderstaande tabel en grafiek. We laten de lijn door 0 gaan door overal de blanco meetwaarde vanaf te trekken. Als we een lineaire relatie hebben kunnen we de lijnvergelijking gebruiken om de concentratie van het monster uit te rekenen. |
|
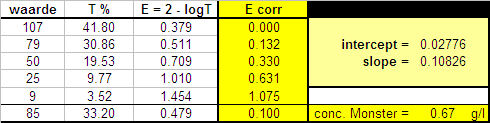 |
|
|
De grafiek laat zien dat we een redelijk lineair correlatie hebben. |
|
 |
|
Discussie en conclusie:
| De kleurreactie waarvan we
gebruik maken in dit experiment is die van Jood met zetmeel waarbij
een donkerblauwe kleur gevormd wordt. Een donkerblauwe kleur is ook beter te zien tegen een
witte achtergrond waardoor dus tevens de gevoeligheid (detectiegrens)van de
reactie verbeterd wordt. Een groot aantal maltose-eenheden door een 1a-4 binding aan elkaar gekoppeld levert zetmeel op volgens: 1/2 n C12H22O11 --> (C6H10O5)n + 1/2 n H2O |
|
|
|
Er komen echter ook
vertakkingen voor en zetmeel is hierdoor colloÔdaal oplosbaar in water (en
dat heet stijfsel). RŲntgen analyse van zetmeel heeft laten zien dat de ketens gedraaid zijn in de
vorm van een helix (als een wenteltrap). In die helix is net genoeg plaats voor
een jodium-molecuul. De blauwe kleur wordt veroorzaakt door de gevangen
jodiummoleculen. Er is dus niet echt sprake van een reactie. Er ontstaat een zetmeel-jodium
complex en dat geeft de blauwe kleur. Deze reactie is niet echt specifiek elke stof die met jodide een redox-reaktie kan aangaan waarbij jood gevormd wordt zal in principe de donkerblauwe kleur veroorzaken. |
| Ook dient hier opgemerkt te
worden dat als jood opgelost wordt in water in aanwezigheid van jodide ionen
de tri-jodide en penta-jodide ionen gevormd worden volgens: I2 + I- --> I3- I2 + I3- --> I5- De ionen worden lineair gerangschikt in het complex. |
|
| Met deze methodiek hebben we berekend dat de concentratie zetmeel in de monsteroplossing 0.67 g/l is. Aan de centrifugebuis hadden we 40 ml water toegevoegd hetgeen betekent dat er in de oplossing ca. 27 mg zetmeel zat. We waren uitgegaan van 2 g. pasta hetgeen dan zou overeenkomen met een zetmeelgehalte van 1.3% in de patat. Onmiddellijk moet er een lampje gaan branden. Dit getal is veel te laag. Een aardappel bestaat voor bijna 100% uit zetmeel. Dit betekent dat we de vraag moeten beantwoorden: wat is hier fout gegaan? Op zich is dat niet moeilijk te deduceren. Om de oplossing zo helder mogelijk te houden heb ik alleen maar vloeistof uit de buis in bewerking genomen, m.a.w. ik heb alleen die zetmeel in bewerking genomen die oplosbaar was in water. Het grootste deel (zie ook de foto) was echter niet oplosbaar in water en bleef achter als vaste stof. Goed beschouwd heb ik dus niet het zetmeelgehalte van patat bepaald maar wel hoeveel zetmeel oplosbaar is in water. Dat is toch iets anders. De conclusie is dan ook dat onze voorbewerking niet deugt als we het zetmeelgehalte in aardappel willen bepalen. | |
| Op zich til ik daar niet echt aan in dit experiment. Ik wilde eigenlijk alleen maar weten of ik mijn digitale camera als spectrofotometer kon gebruiken. Dat laatste is dus wel gelukt. | |
Opmerkingen:
|
Literatuur:
Relevante websites: Minder relevante websites: |
Achtergrondinformatie:
| Zetmeel: Andere naam: Formule: Zetmeel is opgebouwd uit maltose eenheden die via een 1a-4 binding aan elkaar gekoppeld zijn. |
|
|
Colorimeter Een Colorimeter gebruiken we om de concentratie van een oplossing te bepalen door analyse van de kleurintensiteit. De Colorimeter meet de doorgelaten hoeveelheid licht door het monster bij een gekozen golflengte. Het licht van de LED passeert een cuvet met de oplossing. Een lichtgevoelige fotocel aan het uiteinde van de lichtweg detecteert de hoeveelheid doorgelaten licht (transmissie). De concentratie van de testsubstantie kan worden bepaald met een curve volgens de wet van Beer, welke zegt dat de concentratie van een stof rechtevenredig is met de absorptie. |
|
18-01-2017