Iodoform onder de Microscoop


|
Iodoform onder de Microscoop |

|

|
Datum: Juni 2010
Inleiding:
| Tijdens het literatuuronderzoek voor een ander experiment kwam ik een microchemisch artikel over de iodoform reactie tegen. Interessant genoeg om zelf te proberen en een klein beetje aan de moderne tijd aan te passen. |
Principe:
Iodoformkristallen gemaakt m.b.v. sublimatie.
Materiaal:
|
|
 |
Objectglaasje met ingeslepen holte.
|
Uitvoering:
|
 |
|
|
|
 |
||
|
 |
||
Resultaten:
| In onderstaande foto's kan men zien dat de joodkleur verdwenen is. | |
|
|
 |
|
De foto linksboven dient als referentie. De andere foto's zijn resultaten. Men kan zien dat er een goede overeenkomst is tussen observatie en referentie. |
|
|
|
|
 |
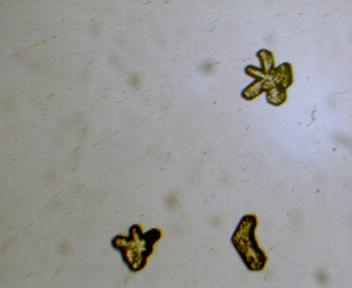 |
| Op het web heb ik nog enkele andere referentieplaatjes gevonden: | |
|
|
|
Discussie en conclusie:
| De reactie die we uitgevoerd hebben is een zgn. iodoform reactie. Deze reactie wordt beschouwd als een aantoningsreactie voor methylketonen en sommige alcoholen. |
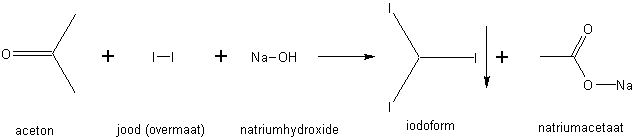 |
| Het is een nucleofiele substitutie reactie. De generieke naam van deze reactie is de Haloform reactie. De reactie is niet gelimiteerd tot monohalogenering zoals men aan het product kan zien vindt er polyhalogenering plaats. De reden is dat de electronegativiteit van het halogeen de stabiliteit van het enolaat bevordert. De reactiesnelheid is onafhankelijk van het type halogeen, ze is even snel voor chloor, broom en jood. |
| De reactie is ontdekt door A. Lieben in de 19de eeuw (A. Lieben; Justus Liebigs Annalen der Chemie; 1870; Suppl. 7; p. 218). |
| Het generieke reactiemechanisme is in onderstaande schema weergegeven: |
|
|
| De eerste stap is een zuur base reactie. Het basische hydroxide ion verwijderd het zure alpha-proton waardoor het enolaat gevormd wordt. In de tweede stap reageert het nucleofiele enolaat met het halide waaroor het gehalogeneerde keton en een halogenide ion gevormd wordt. |
Literatuur:
|
Relevante websites:
Opmerkingen:
|
Achtergrondinformatie:
| Naam: |
iodoform triiodomethane |
||
| Formule: |
CHI3 |
|
|
| Molmassa: | 393.73 g/mol | ||
| Smeltpunt: | 115 įC | ||
| Cas no.: | 75-47-8 | ||
| Kenmerken: | Kleine
groenige of gelige kristallen met hexagonale kristalstructuur. Penetrerende geur. |
||
| Oplosbaarheid: |
Oplosbaar in benzeen en aceton. Gedeeltelijk oplosbaar in alcohol, glycerol, chloroform, CS2 en ether. Onoplosbaar in water. |
||
| Bereiding: | a.
Door het opwarmen van aceton of methanol met jood in aanwezigheid van een
base of een basisch carbonaat. b. Elektrolytisch, door een stroom te leiden door een oplossing die kaliumjodide, alcohol en natriumcarbonaat bevat. |
||
| Gebruik: | Als antiseptisch middel | ||
26/09/2010