

| Zuurstof uit Kaliumpermanganaat en enige andere observaties |  |
 |
Datum: februari 2003
Principe:
Door verwarming van het kaliumpermanganaat zuurstof produceren.
Materiaal:
|
|
Uitvoering:
|
|
Resultaten:
|
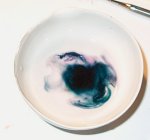
Als snel kunnen we de vorming van gasbellen waarnemen. In eerste instantie is dit alleen maar de uitzetting van de lucht die verwarmd wordt maar als snel kunnen we een fikse gasontwikkeling waarnemen. We zien ook dat de kleur van het kaliumpermanganaat veranderd, het wordt zwart. Indien we in een gloeiende houtspaander in de gasopvangbuis steken gaat deze weer branden. Voegen we het zwarte poeder aan het water toe dan zien we dat het water zich eerst diepgroen kleurt en na enige tijd weer paars wordt. Voegen we het poeder aan de loogoplossing toe dan houdt de groen kleur zich langer in stand. Bij het toevoegen van zoutzuur kleurt de oplossing zich weer violet. De verkleuringen worden getoond in de onderstaande fotoserie. |
|
|
|
| in water | in water | in water | in water |
 |
 |
 |
 |
| in loog | in loog | zuur toevoegen | zuur toevoegen |
 |
 |
 |
 |
Discussie en conclusie:
| De ontledingsreactie van kaliumpermanganaat
verloopt als volgt: 2KMnO4 --DT --> K2MnO4 + MnO2 + O2(g) K2MnO4 wordt
kaliummanganaat genoemd, het MnO4 heeft nu een -2 lading. De productie van zuurstof wordt aangetoond m.b.v. de gloeiende houtspaander test. Kaliummanganaat in water kleurt groen. In vele gevallen wordt het verloop van de reactie bepaald door het milieu waarin het zich bevindt meer specifiek door de pH van de oplossing. In de alkalische oplossing wordt de omzetting van het groene manganaat naar het paarse permanganaat geremd. Door het toevoegen van zuur wordt deze remming weer opgeheven. Een methode om de verschillende oxidatie toestanden van mangaanionen weer te geven is m.b.v. Frost of oxidatietoestandsdiagrammen. Hierin wordt de relatieve vrije energie van een ion uitgezet tegen de oxidatietoestand. De waardes op de y-as geplot worden verkregen door het aantal elektronen dat overgedragen wordt tijdens de reactie te vermenigvuldigen met de standaard reductiepotentiaal verandering. Het thermodynamisch meest stabiele ion vindt men dan op het allerlaagste punt in het diagram (gezien vanuit een oxidatie-reductie perspectief). Ionen die hier gelocaliseerd zijn worden dus spontaan gevormd. Een ion gelokaliseerd boven-links in de plot is een sterke oxidator, en rechts-boven een sterke reductor.
De kleur, vorm en oxidatietoestand van de verschillende mangaan-ionen in oplossing wordt weergegeven m.b.v. een Pourbaix diagram, het laat zien welke ionen dominant zijn onder bepaalde condities. Net zoals Frost diagrammen geven ze een thermodynamische presentatie weer, de kinetiek wordt echter buiten beschouwing gelaten.
In BINAS en op het web vinden we de volgende normaal redoxpotentialen:
(1) De reacties vinden plaats in oplossing; alle ionen zijn gehydrateerd. De concentraties van de opgeloste deeltjes zijn steeds 1.00 mol/l, T=298 K; p=p0. Met de wet van Nernst: pA + qB + … + ne ó rC + sD + …
Als P=1 atm en a=1 kan de Nernstvergelijking getransformeerd worden in de logvergelijking. Willen we de disproportionering van MnO42- beschrijven dan kan dat m.b.v. het volgende reactieschema:
Passen we dit toe in de Nernstvergelijking dan krijgen we:
Dus bij pH = 0 geldt K =1057 Hetgeen dus betekent dat in indien we zuur en basisch milieu met elkaar vergelijken dat, thermodynamisch gezien, in basisch milieu het evenwicht richting MnO42- ligt. |
Literatuur:
Relevante websites: |
Achtergrondinformatie:
18-01-2017