Kristallisatie uit een oververzadigde oplossing


|
Kristallisatie uit een oververzadigde oplossing |
 |
 |
Datum: december 2003
Principe:
Uitkristalliseren uit een oververzadigde oplossing.
Materiaal:
|
|
Uitvoering:
|

|
Resultaten:
|
NaCl kristal toegevoegd |
|
 |
 |
|
Natriumacetaat kristal toegevoegd |
|
 |
 |
 |
 |
 |
 |
| Tijdens de kristallisatie komt er een aanzienlijke hoeveelheid warmte vrij. | |
| Vergelijk NaCl en NaAc kristal onder QX3 microscoop | Vergelijk NaCl en NaAc petrischaal |
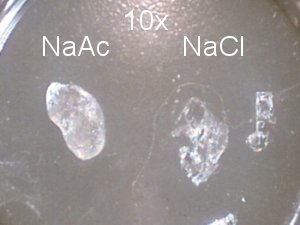
|
 |
| NaCl 60x | NaAc 60x |

|

|
Discussie:
| Kristallisatie is
een proces dat plaatsvindt in twee stappen. In de eerste stap worden
nuclei gevormd (ion- of molecuulaggregaten). In de tweede stap vormen deze
nuclei door samensmelting de kristallen. De nuclei worden continue gevormd
in de oplossing maar vallen ook weer continue uit elkaar. Om als groeikern
te kunnen fungeren moeten ze eerst een bepaalde kritische grootte
bereiken. Natriumacetaat is bijzonder geschikt voor dit soort experimenten omdat de gevormde nuclei in de oplossing niet deze minimale grootte kunnen bereiken die nodig is voor een "seed" kristal oftewel een entkristal. Het is dus mogelijk om een oververzadigde oplossing van natriumacetaat te maken en te bewaren met een concentratie die boven het verzadigingsevenwicht ligt. De kristallisatie wordt nu ge´nitieerd door het toevoegen van een entkristal aan de oplossing. Aangezien de oververzadigde oplossing ver van het evenwicht afligt zal de toevoeging van een geschikt kristal ervoor zorgen dat precipitatie zal plaatsvinden van het overmaat zout in de oplossing totdat het evenwicht bereikt is. Het proces vindt zeer snel plaats en er wordt ook een aanzienlijke hoeveelheid warmte gevormd. Duidelijk is te zien dat niet elk kristal als groeikristal kan dienen. Zoutkristallen hebben een ander structuur dan natriumacetaat kristallen en zien niet in staat om de kristallisatie op gang te brengen terwijl een klein kristal natriumacetaat voldoende is om de kristallisatie op gang te brengen. |
Conclusies:
|
Opmerkingen:
|
Literatuur:
Relevante websites: Minder relevante websites |
Achtergrondinformatie:
| De werking van een typische "hot pack"
berust op een fase verandering of chemische reactie waarbij warmte
vrijkomt. Een van de meest bekende is die gebaseerd op natriumacetaat waarbij de warmte geleverd wordt door de kristallisatie van natrium acetaat volgens: NaAc.3H2O (l) --> NaAc.3H2O (s) + 150 kJ/mol. Maar hoe krijg je dit nu voor elkaar binnen een pakje? De "hot pack" is eigenlijk een plastic zakje met daarin een oplossing van natriumacetaat in water. Beneden de 40 ░C vormt dit mengsel nu een oververzadigde oplossing die als kenmerk heeft dat deze niet spontaan zal uitkristalliseren. Voor kristallisatie hebben we een externe "trigger" nodig. Dat kan een entkristal zijn maar ook een drukpuls kan hetzelfde effect hebben (deze veroorzaakt kleine gasbelletjes die ook min of meer als een soort entkristal kunnen fungeren). Door nu het plastic zakje samen te drukken veroorzaak je zulk een drukpuls die de kristallisatie laat beginnen waardoor, gedurende enkele seconden, de warmte vrijkomt. Een alternatieve manier om een hotpack te maken is mbv CaCl2 (Bison vochtvreter). Breng je deze in contact met water dan komt er ook warmte vrij. Door nu een ampul CaCl2 in een zakje met water te brengen maak je ook een hotpack. De warmte komt vrij op het moment dat je de ampul kapot maakt.
|
| In de (acetaat) hotpacks op de
foto's zit een metalen plaatje dat je moet laten knakken om de
kristallisatie op gang te brengen. Een verklaring hiervoor is dat je zoals hierboven beschreven met een drukpuls de kristallisatie op gang brengt. Een alternatieve verklaring is echter dat je op deze manier enkele metalen deeltjes in de oplossing brengt die als entkristal kunnen fungeren. Ik weet niet met zekerheid welke van de twee de echte verklaring is. |
|
| In de hotpacks op de foto's zit een
metalen plaatje dat je moet laten knakken om de kristallisatie op gang te
brengen. Een gebruikt (acetaat) hotpack kun je weer regenereren door het voorzichtig te verwarmen in een pan met water zoal aan deze foto's te zien is. |
 |
 |
 |
 |
 |
08-01-2017