

| Synthese van salmiak |  |
 |
Datum: augustus 2002
Principe:
| Synthese van ammoniumchloride door ammonia met zoutzuur te laten reageren. |
Materiaal:
|
Uitvoering:
|
Resultaat:
|
Na indampoen vormen zich prachtige kristallenstructuren. Indien men een klein beetje vloeistof in een schaaltje giet en het daar laat verdampen kan men deze bestuderen m.b.v. een microscoop. |
|
 |
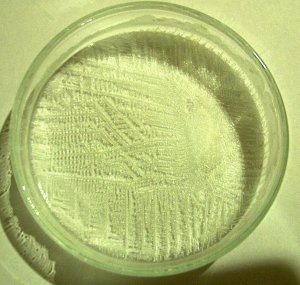 |
| met flitser | zonder flitser |
 |
 |
| 10x | 10 X |
 |
 |
| 60x | syntheseresultaat |
Discussie en conclusie:
| Het principe van de synthese is een zuur-base reactie:
NH3 + H3O+ + Cl- --> NH4+
+ Cl- + H2O Dampen we daarna het water af dan krijgen we ammoniumchloride (NH4Cl) oftewel salmiak. De zuiverheid van het materiaal wordt bepaald door de onzuiverheden die in het zoutzuur en de ammonia aanwezig waren en niet verdampten. Het rendement is nogal laag door de relatief verdunde oplossingen die we gebruiken Uiteindelijk hebben we ca. 3-4 g salmiak gemaakt, uitgaande van ca. 30 ml ammonia en 30 ml zoutzuur. |
Opmerkingen:
|
Literatuur:
|
Achtergrondinformatie:
|
Salmiak: Letterlijk “Ammonszout”, is de gezochte term de veel gebruikte naam voor de chemische verbinding ammoniumchloride, NH4Cl, die wordt verkregen door ammoniakgas in zoutzuur te leiden. Komt in de natuur voor in vulkanische gebieden als een aan Haliet verwant mineraal; ontstaat ook als bijproduct bij de sodabereiding volgens het solvayproces. Het kan bereid worden door gefractioneerde kristallisatie uit een oplossing bevattende ammoniumsulfaat and keukenzout of ammoniumcarbonaat en calciumchloride. Zuiver materiaal kan rechtstreeks gemaakt worden door de gasfase reactie van ammonia en zoutzuur.
|
||||||||||||||||||||||||||||||||
17-01-2017