Roestvorming als exotherme reactie


|
Roestvorming als exotherme reactie |
 |
 |
Datum: Maart 2014
Principe:
Roesten is een chemische reactie waarbij warmte geproduceerd wordt.
Materiaal:
|
 |
|
|
|
Uitvoering:
|
|
|
|
|
|
Staalwol |
Screenshot |
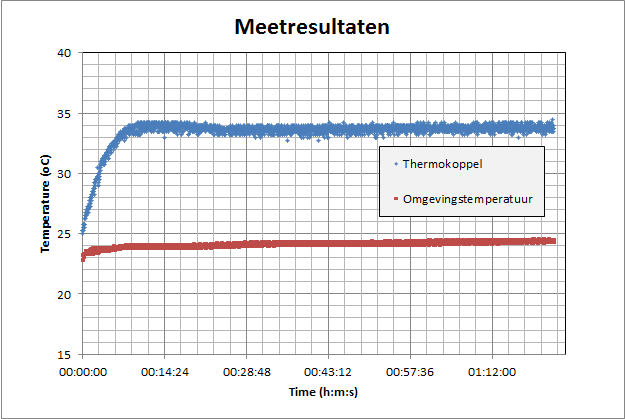
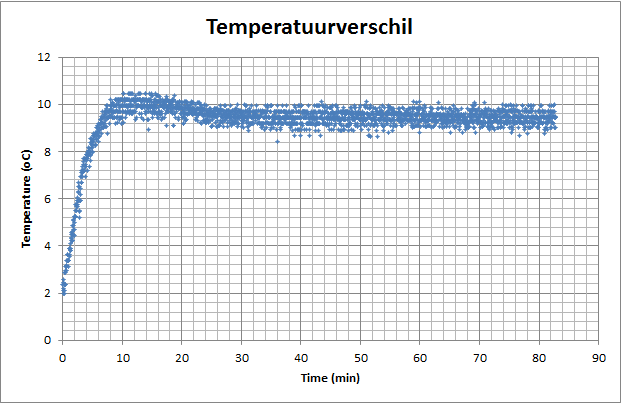
Resultaten:
|
Observaties: |
|
 |
 |
| Na enige tijd kan men condensvorming zien. | Na openen kan men zien dat een deel van het staalwol verroest is. |
 |
|
 |
|
|
Gemiddeld temperatuurverschil na 20 min t.o.v. de omgeving = 9.5 įC |
|
Discussie:
|
De volgende reacties hebben plaatsgevonden tijdens het experiment. 1. Ijzer + azijnzuur vormen een ijzer ion, een azijnzuur ion en waterstofgas Fe + 2CH3COOH --> Fe2+ + CH3COO- + H2 ( ≠)2. IJzer en zuurstof reageren onder de vorming van ijzeroxide of roest en warmte 4Fe + 3O2 --> 2Fe2O3 + DHDe reactie met azijnzuur zorgt ervoor dat het beschermde laagje dat rond het staalwol zit verwijder wordt waardoor het ijzer kan gaan roesten. Tijdens het roesten komt warmte vrij die we kunnen meten. |
|
|
De temperatuurstijging die we waargenomen hebben laat zien dat er warmte vrijkomt hetgeen aangeeft dat we met een exotherme reactie te maken hebben. |
|
|
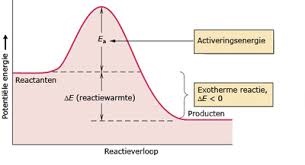
Bij een exotherme reactie ligt het energieniveau van de uitgangsstoffen hoger dan dat van de reactieproducten. Bij de vorming van de reactieproducten komt er dan energie vrij in de vorm van warmte die afgegeven wordt aan de omgeving. Alhoewel er een sterke drijvende kracht is om zulk een reactie te laten verlopen gebeurt dat vaak niet spontaan. Men kan vaak echter pas een reactie op gang krijgen, door als het ware eerst een berg passeren, men moet eerst energie toevoegen. De reactie moet geactiveerd worden. Als deze activeringsenergie eenmaal is toegevoegd loopt de reactie vanzelf aangezien er dermate veel energie geproduceerd wordt dat de men automatische over de energiedrempel heengaat.. |
 |
|
Als men het botsingsmodel hanteert zegt men dat moleculen eerst een hoeveelheid kinetische energie moeten bezitten die minimaal gelijk is aan de activeringsenergie zodat men tot een effectieve botsing en dus reactie kan komen. Als eenmaal een kleine hoeveelheid moleculen de benodigde activeringsenergie heeft verkregen, is de vrijkomende reactie-energie voldoende om andere, en steeds meer, moleculen over de energiedrempel heen te helpen. Vandaar dat als een exotherme reactie een maal verloopt, deze zichzelf verder in stand houdt. |
|
|
De DH voor deze reactie is de som van de DHfo's van de producten - de som van de DHfo'van de reactanten (vermenigvuldigd met hun stoichiometrische coŽfficiŽnten uit de reactie vergelijking):
|
|
Conclusie:
|
Opmerkingen:
|
Literatuur:
Relevante websites: Minder relevante websites: |
Achtergrondinformatie:
| Reactiewarmte De reactiewarmte of de verandering in enthalpie van een reactie is de hoeveelheid warmte die afgegeven of opgenomen wordt als een reactie uitgevoerd wordt bij constante temperatuur en druk.
Als een chemische verbinding opgebouwd wordt uit de bijbehorende elementen dan noemt de reactiewarmte de vormingswarmte (DHf). De vormingswarmtes van verbindingen zijn getabuleerd bij 298 K alwaar men ze de standaardvormingwarmte noemt (DH0f) |
| Exotherm of endotherm Chemische reacties zijn oftewel endotherm (nemen warmte uit de omgeving op) of exotherm (geven warmte af). Het effect dat de temperatuur heeft op een chemisch evenwicht kan voorspeld worden mbv Le Ch‚telier's principe. Als de reactie endotherm is zal een stijging van de temperatuur resulteren in een verschuiving van het evenwicht naar rechts. In een exotherme reactie verschuift het evenwicht naar links. De temperatuurafhankelijkheid van de evenwichtsconstante wordt weergeven door de van't Hoff vergelijking:
hierin is H˚ de enthalpie verandering van de reactie, R de universele gas constante (8.31 J K-1mol1), en K1 en K2 , de evenwichtsconstante bij temperatuur T1 en T2. |
12-08-2014