

| Bepalen van het smeltpunt van kaarsvet |
 |
 |
Datum : 17-11-2001
Principe:
| Het smeltpunt van een was is die temperatuur van de was waarbij, bij verwarming de vaste stof vloeibaar wordt of bij afkoeling de vloeistof vast wordt. Smelt een beetje was door gebruik te maken van de warmte van heet water. Laat de was dan afkoelen tot deze weer vast wordt. Bij die temperatuur waarbij die temperatuur constant blijft is het smeltpunt van de was. |
Benodigd:
|
|
Werkwijze:
|
Meetresultaten:
Tijd Temp. (min) (°C) 0,0 95,7 0,5 94,5 1,0 91,0 1,5 87,2 2,0 83,6 2,5 80,1 3,0 76,7 3,5 73,7 4,0 70,7 4,5 67,9 5,0 65,3 |
Tijd Temp. (min) (°C) 5,5 62,9 6,0 60,7 6,5 58,6 7,0 57,3 7,5 56,6 8,0 56,2 8,5 55,9 9,0 55,7 9,5 55,7 10,0 55,8 10,5 55,8 |
Tijd Temp. (min) (°C) 11,0 55,8 11,5 55,7 12,0 55,6 12,5 55,3 13,0 55,1 13,5 54,8 14,0 54,4 14,5 54,0 15,0 53,6 15,5 53,1 16,0 52,5 |
Tijd Temp.
(min) (°C)
16,5 52,0
17,2 50,9
18,5 49,4
19,0 48,7
20,0 47,3
21,0 46,0
22,0 44,5
23,5 43,1
25,5 41,1
27,0 40,0
|
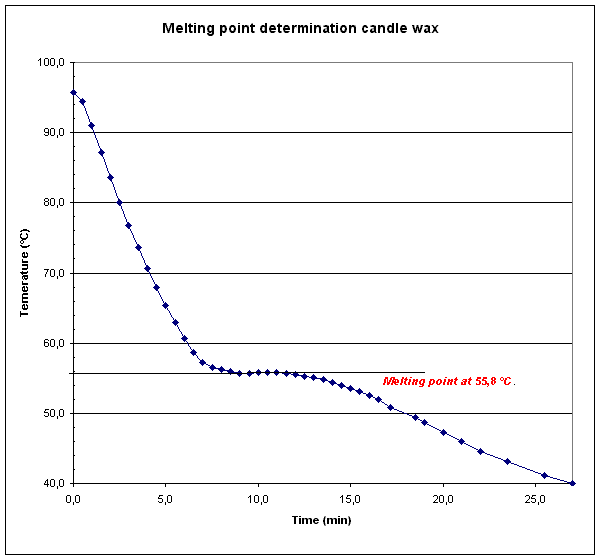
Discussie en conclusie:
| Het gevonden smeltpunt is 55.8 °C. Als monster heb ik een waxinelichtje gebruikt. In Nederland begon Verkade met het produceren van waxine thee- en nachtlichtjes, gemaakt van paraffinewas, in een fabriek in Amsterdam (1898). Het patent werd gekocht van de Engelse Morris Fowler, de schoonzoon van E.G. Verkade. Waxine is nu van merknaam een soortnaam geworden en staat als zodanig in het woordenboek vermeld. In de literatuur (Binas/Merck Index) kunnen we vinden als smeltpunt:
Volgens de literatuur is de smeltwarmte ongeveer 210-250 J/g |
Literatuur:
|
Achtergrondinformatie:
| Volgens de kinetische molecuul theorie
is materie opgebouwd uit moleculen die voortdurend in beweging zijn,
waarbij de mate van beweging afhankelijk is van de temperatuur.
Moleculen oefenen krachten op elkaar uit waarbij de sterkte van deze
krachten afhankelijk zijn van de temperatuur en de fase (vast,
vloeistof, gas). Als materie verwarmd wordt (we voegen energie toe) gaat de temperatuur van het betreffende object ook omhoog hetgeen kan leiden tot een toestandsverandering. De inwendige energie neemt toe (als de temperatuur omhoog gaat, neemt de kinetische energie toe omdat de moleculen sneller gaan bewegen, zowel in termen van vibratie als in termen van rotatie - Ekin=½mv2). Bij de overgang van vast naar vloeistof worden relatief grote hoeveelheden potentiële energie opgeslagen zonder verandering van de gemiddelde kinetische energie of de temperatuur. Gedurende smelten of kristalliseren verandert de temperatuur dus niet (dit kunnen we ook waarnemen in het experiment). Om een mol was te laten smelten is een constante hoeveelheid energie nodig, deze hoeveelheid energie noemen we de smeltwarmte. De molaire smeltwarmte is dus de hoeveelheid energie die nodig is om een mol stof te laten smelten bij het smeltpunt. Deze energie wordt gebruikt om de aantrekkingskracht tussen de was moleculen te verbreken zodat de driedimensionale structuur van de was verbroken wordt. De thermodynamische benadering. Voor een enkelvoudige stof geldt dat, indien bij een bepaalde temperatuur en druk twee fases met elkaar in evenwicht zijn, de chemische potentiaal gelijk is. In het geval van een vaste stof in evenwicht met een vloeistof geldt dus:
Bij een verandering van temperatuur en druk geldt dan dat de chemische potentiaal nieuwe waardes heeft gekregen, m.a.w.:
Aangezien
Dit betekent dat: Kijken we nu naar de vrije enthalpie dan geldt de toestandsfunctie: G = H – TS Hetgeen de volgende differentiaal geeft:
In combinatie met de andere toestandsvergelijking: H = U + pV Hetgeen de volgende differentiaal geeft:
Gecombineerd krijgen we dan:
Volgens de eerste hoofdwet (U=A+Q) geldt bij een reversibel proces waarbij alleen arbeid wordt verricht door vergroting van het volume:
Ingevuld geeft dat:
M.a.w. voor de hierboven besproken chemische potentiaal geldt:
geeft:
In de evenwichtstoestand is DG=0 en geldt dat DH=TDS dan kunnen we schrijven dat:
D H is in dit geval de verandering van de enthalpie bij de fase overgang (hier van S --> L, en is dus de smeltwarmte). DV is de volumeverandering die bij de faseovergang optreedt. Bij een overgang van een vaste naar een vloeibare fase neemt de wanorde toe, we gaan van een "rigide" geordende structuur naar een minder geordende, meer chaotische structuur, de entropie neemt dus toe. De smeltenthalpie is positief en de volumeverandering is meestal positief en klein met als gevolg dat dp/dT steil is en meestal positief. We kunnen nu de formule voor de faseovergang afleiden door dp/dT te integreren waarbij we aannemen dat DH en DV dermate weinig veranderen dat we ze als constant kunnen beschouwen. Dus, bij een smelttemperatuur T* met een bijbehorende druk p* krijgen we:
Hetgeen betekent dat we de S-L overgang ongeveer kunnen beschrijven met:
Deze vergelijking werd oorspronkelijk verkregen door Lord Kelvin.
Dus,
Dit is de vergelijking van een rechte lijn als we p tegen T uitzetten. |
18-01-2017