

| Alcoholische gisting |  |
 |
Datum: december 2002 - februari 2003
Principe:
Gistingsactiviteit nader bestuderen.
Materiaal:
|
|
Uitvoering:
|
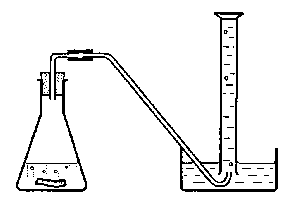
|
|
|
Meetresultaten:
| EXPERIMENT 1 | Temperatuur : 22.5 °C |
opstelling |
||
| Continue Meeting | Start
experiment: 29 december om 16:42 u. |
|||
| Tijd (hh:mm) | ml verplaatst | |||
| 00:00 00:15 00:30 00:32 00:39 00:46 00:52 00:58 01:03 01:07 01:12 01:17 01:21 01:26 01:30 01:35 01:39 01:44 01:49 |
0 4 30 41 87 137 189 244 294 344 394 444 494 544 594 644 694 744 794 |
Gist oplossing: 10
g Suiker: 26 g Water: 250 g |
||
| Op het moment, na ca. 2 uur toen overgeschakeld zou worden naar activiteitsmetingen moest het experiment afgebroken worden. Door de schuimvorming werd de gistsuspensie door het slangetje geperst. |
gasvorming |
|||
| Tijdens het experiment hebben we wat gas door een oplossing van kalkwater geleid. Deze werd troebel. |
voor |
na |
||
| EXPERIMENT 2 | Temperatuur : 21.5 °C | |
| Continue Meeting | Start
experiment: 30 december om 14:34 u. |
|
| Tijd (hh:mm) | ml verplaatst | |
| 00:00 01:00 02:15 04:46 04:50 05:02 |
0 0 0 0 10 58 |
Gist oplossing:
3 g Suiker: 27 g Water: 250 g De gistconcentratie verlaagd om 2 redenen. Het effect hiervan bepalen en hopelijk resulteert dit in minder sterke schuimvorming. Waarschijnlijk een lek op de afsluiting gehad. Daarom initieel geen activiteit gemeten. Ik kon dit zien aan de schuimvorming. Daarom overgegaan op activiteitsmetingen in min/50 ml gas productie. Wederom werd dit experiment geplaagd door sterke schuimvorming na ca. 6 uur. |
| Activiteitsmeting | ||
| Tijd (hh:mm) | min/50 ml CO2 | |
|
05:02-05:15 06:04-06:19 19:33-20:35 31:00-32:12
|
13 15 62 72 |
|
| EXPERIMENT 3 | Temperatuur : 21.5 °C | |
| Continue Meeting | Start
experiment: 1 januari om 13:55 u. |
|
| Tijd (hh:mm) | ml verplaatst | |
| 00:00 01:00 01:30 01:46 02:10 02:28 02:44 02:59 03:13 03:26 03:39 03:52 04:04 04:18 |
0 18 33 50 102 152 202 252 302 352 402 452 502 554 |
Gist oplossing:
3 g Suiker: 12 g Water: 200 g
Ook nu is na 6-7 uur de schuimvorming dermate groot geworden dat men niet zo goed kan meten omdat het slangetje zich dan met gist vult. |
| Activiteitsmeting | ||
| Tijd (hh:mm) | min/50 ml CO2 | |
| 04:58-05:12 19:00-20:14 22:55-24:07 27:23-28:15 29:37-30:18 43:38-51:20 |
14 74 72 100 (26 ml) 89 (23 ml) 513 (45 ml) |
|
| EXPERIMENT 4 | Temperatuur : 21.2 °C | |
| Continue Meeting | Start
experiment: 4 januari om 18:30 u. |
|
| Tijd (hh:mm) | ml verplaatst | |
| 00:00 00:20 00:45 00:52 01:07 |
0 8 (?) 19 (?) 30 (?) 50 (?) |
Gist oplossing:
3 g Suiker: 25 g Water: 200 g (?) vermoedde een lek, veel geschud en geprobeerd. |
| Activiteitsmeting | ||
| Tijd (hh:mm) | min/50 ml CO2 | |
| 02:07-02:26 02:28-02:44 02:45-03:00 03:03-03:18 03:18-03:33 03:34-03:48 04:48-05:05 16:24-17:36 17:57-18:52 23:27-25:32 |
19 16 15 15 15 15 17 68 (53ml) 55 (35 ml) |
|
Na 4 experimenten was de gist op.
Discussie:
In de gist aanwezige enzymen kunnen bepaalde suikers vergisten tot ethanol. Bij de gisting van gewone suiker heeft men te maken met een proces dat opgebouwd is uit twee stappen:
1. De suiker wordt gehydrolyseerd door de in de gist aanwezige enzymen tot glucose en fructose.
Reactie : C12H22O11
+ H2O -----> 2C6H12O6
(glucose/fructose)
2. Glucose en fructose worden dan door de in de gist aanwezige enzymen omgezet in ethanol en CO2.
Reactie : C6H12O6 -----> 2C2H5OH + 2CO2
De netto reactie wordt dan: C12H22O11 + H2O -----> 4C2H5OH + 4CO2
Dat inderdaad CO2 gevormd wordt
hebben we aangetoond door wat gas door een kalkwater oplossing te leiden:
Waarneming : De oplossing
van kalkwater wordt troebel
Reactie : CO2 (g) + Ca(OH)2 --> CaCO3 (s)
+ H2O
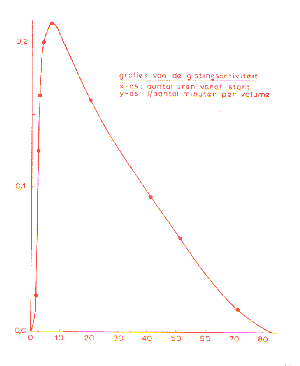
| Een volledige vergistingcurve,
waarbij de activiteit op de y-as wordt geplot t.o.v. de tijd zou eruit
zien zoals in de figuur hiernaast.
Helaas hebben we niet genoeg datapunten verzameld tijdens een van de experimenten om een dergelijke curve te kunnen samenstellen. Om relevante conclusies te kunnen trekken is dit echter ook niet nodig, de initiële activiteit is daarvoor voldoende, zoals we laten zien bij de behandeling van de enzymkinetiek (zie achtergrondinformatie).
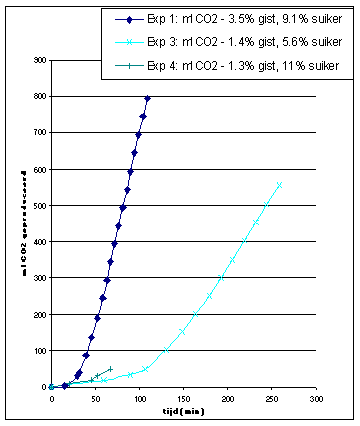
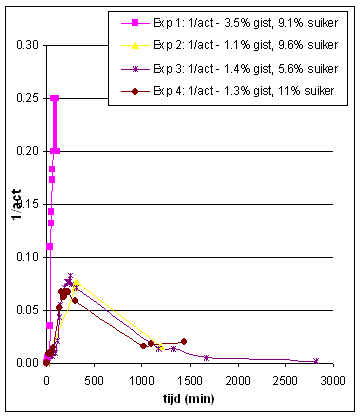
Vertalen we de meetresultaten in grafieken dan krijgen we het hieronderstaande resultaat.
|
 |
||||||||||||||||||||||||||||||
|
CO2 produktie |
activiteit |
||||||||||||||||||||||||||||||
 |
 |
||||||||||||||||||||||||||||||
| Dit zijn echter
min of meer rechtlijnig afgeleide grafieken. We willen echter een
Lineweaver-Burk plot maken (Zie Achtergrondinformatie voor meer details over deze plot). |
|||||||||||||||||||||||||||||||
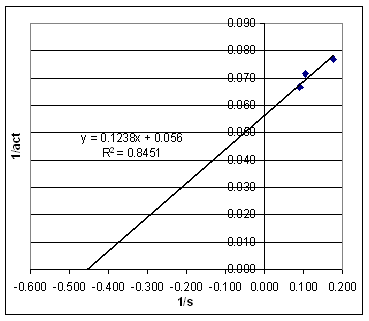
| Vatten we alle resultaten samen in een tabel: |
Lineweaver - Burke plot |
||||||||||||||||||||||||||||||
De resultaten van EXP 1 zijn niet bruikbaar voor de LB plot aangezien de gist concentratie sterk verschillend is t.o.v. de andere experimenten. We kunnen uit dit experiment, indien we het vergelijken met de andere, echter wel concluderen dat een toename van de enzymconcentratie de reactie versneld. Plotten we de zo verkregen waarden in een
LB plot dan krijgen we nevenstaand resultaat met act in min/50 mol CO2
en s in %. |
 |
||||||||||||||||||||||||||||||
| Normaliter worden dergelijke
getallen echter in mol/l en mol/min uitgedrukt.
We kunnen de getallen hierboven echter
(grofstoffelijk) omrekenen: De grafiek die we nu echter krijgen lijkt niet meer op de LB plot zoals we die verwachten. De hellingshoek loopt opeens anders. |
|
||||||||||||||||||||||||||||||
| We worden hier geconfronteerd met het verschil tussen model en werkelijkheid. M.a.w. de vergisting van suiker zoals we die hier hebben uitgevoerd kunnen we niet modelleren door alleen maar gebruik te maken van MM kinetiek. Dat is eigenlijk ook wel logisch. We hebben hier niet met een MM reactie te maken maar met een 2 staps proces. De hydrolyse, die ook nog eens 2 verschillende suikers oplevert en de conversie van de suikers naar CO2. I.p.v. een eenvoudige MM reactie hebben we dus te maken met meerdere reacties. | |||||||||||||||||||||||||||||||
Conclusie:
Opmerkingen:
We gebruiken een zoutoplossing i.p.v. water om het oplossen van CO2 in water tegen te gaan.
Vet de afsluitingen in met vaseline of siliconenvet om het geheel zo gasdicht mogelijk te maken.
Zoals aan de foto te zien is heb ik de proefopstelling enigszins aangepast aan de materialen die ik bij de hand had, nl. een infuus slangetje met holle naald en een rubberen afsluitdop.
Met een flexibel slangetje kan men na het opnieuw vullen en plaatsen van de maatcilinder alle lucht eruit zuigen zodat deze daadwerkelijk op 0 staat.
Het is beter om de oplossing te roeren gedurende het experiment. Het gebruik van deze flesjes maakt dat echter niet mogelijk.
Dit is echt een experiment waarvoor geldt: al doende leert men. Zorg dus voor voldoende gist, suiker en tijd om het meerdere malen te kunnen doen. Op deze manier kunnen we dan de invloed van gist en suikerconcentratie beter onderzoeken. Ook zouden we met een iets andere opstelling de invloed van temperatuur en pH kunnen onderzoeken.
Het zou interessant zijn om te onderzoeken of glucose of fructose wel aan de MM kinetiek voldoet.
Literatuur:
Relevante websites:
Minder relevante websites:
Achtergrondinformatie:
Enzymkinetiek
De vergistingsreactie verloopt aangezien er enzymen aangemaakt worden die ervoor zorgen dat de reacties kunnen verlopen.
Een enzym is een eiwit met katalytische eigenschappen, vanwege hun vermogen om specifieke bindingen te activeren (de activeringsenergie wordt verlaagd).
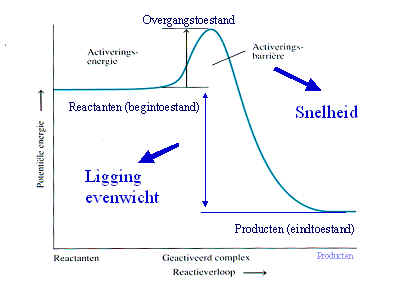
Een enzym heeft naast een eiwitgedeelte (het apo-enzym) vaak nog een andere bouwsteen (de cofactor) nodig voor de katalyserende functie. Het geheel noemt men holo-enzym.
Als cofactor kunnen optreden metaal-ionen (bv Ca2+) of een complex organisch molecuul dat als coenzym functioneert bv NADH
De enzymkinetiek gedraagt zich niet wezenlijk anders dan de normale chemische kinetiek. Vaak heeft men te maken met pseudo-1ste-orde kinetiek (bv als in een 2de orde reactie een de concentraties zeer hoog is en de andere concentratie zeer laag).
In een 1ste orde reactie is de reactiesnelheid evenredig met de concentratie van een reactant.
Voor de reactie: S à P
Geldt dan:
![]() dus
dus ![]()
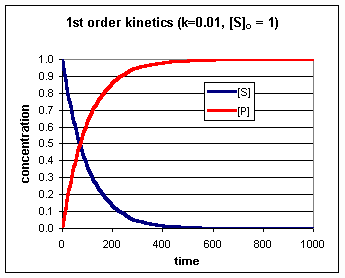
Hieruit volgt ook dat de concentratie van P gemakkelijk te berekenen is volgens:
[P] = [S]0 – [S] (waarin [S]0 de concentratie van S op tijdstip t=0 is).
Het concentratieverloop is grafisch weergegeven in onderstaande figuur.
Bij een enzymatische bepaling laat men het enzym enige tijd inwerken op het substraat en bepaald men de substraat (S) of product (P) concentratie op verschillende tijdstippen (of continue). De kromme die het verband weergeeft tussen bv de hoeveelheid omgezet substraat (de conversie) en de tijd, noemt men de progress-curve.
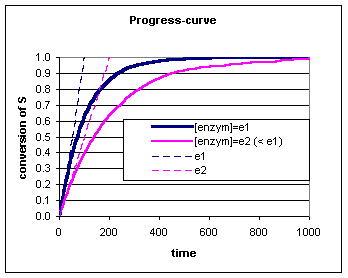
We kunnen in de progress-curve zien dat de conversie van S steeds verder van de raaklijn afwijkt. Voor deze afwijking zijn verschillende oorzaken mogelijk:
Om van deze afwijking geen last te hebben moet men dus meten rond t=0.
Het effect van de verschillende enzymconcentraties kan nog duidelijker zichtbaar gemaakt worden door de reactiesnelheid (de omgezette hoeveelheid per tijdseenheid) als functie van de enzymconcentratie uit te zetten. Door het maken van zulk een curve kan men zien dat alleen op t=0 er een lineair verband bestaat tussen de enzymwerking (reactiesnelheid) en enzymhoeveelheid. De juiste reactiesnelheid wordt dus gevonden door op t=0 de raaklijn aan de progress-curve te trekken. Deze reactiesnelheid noemt men de initial velocity (v0).
Er zijn een aantal factoren die van invloed zijn op de reactiesnelheid (initial velocity):
In 1913 ontwikkelden L.Michaelis en M.Menten (MM) een algemene theorie over de werking van enzymen. Briggs en Haldane breidden deze theorie later uit. Deze uitbreiding staat bekend onder de naam steady-state theorie. De MM theorie vormt de basis van de kwantitatieve analyse van alle aspecten van enzymkinetiek en inhibitie en is het best ontwikkeld voor een (1) substraat. De MM theorie gaat er van uit dat een enzym E met het substraat S een enzymsubstraat complex ES vormt dat in een tweede stap uiteenvalt in vrij enzym E en product P (beide reacties zijn reversibel). De MM vergelijking afgeleid volgens de steady-state theorie geeft het mathematische verband tussen de initial velocity, de concentratie S en enkele karakteristieke kenmerken van een enzym.
Reactie:
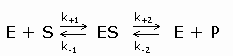
Symbolen:
Volgens de steady state theorie is de vormingssnelheid van ES gelijk aan de ontledingssnelheid.
De vormingssnelheid van ES: ![]() (1)
(1)
Hier verwaarlozen we de terugvorming uit P aangezien op t=0 geldt P=0.
De ontledingssnelheid van ES: ![]() (2)
(2)
(1) = (2) ==> ![]() (3)
(3)
Dus: 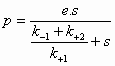 (4)
(4)
De initial velocity (reactiesnelheid op t=0) wordt bepaald door de productvorming uit ES:
![]() (5)
(5)
(4) in (5) geeft: 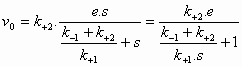 (6)
(6)
De maximale reactiesnelheid (Vmax, S à
![]() ) wordt dan:
) wordt dan: ![]() (7)
(7)
De constante ![]() (8) noemt men de Michaelis-Menten
constante.
(8) noemt men de Michaelis-Menten
constante.
Dus (7) en (8) in (6) geeft de Michaelis-Menten vergelijking:
| Michaelis-Menten vergelijking: | 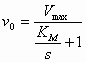 |
of |
Consequenties:
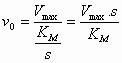
KM is dus gelijk aan de substraatconcentratie die aanleiding geeft tot een initial velocity die gelijk is aan ½ Vmax.
De vorm waarin de MM vergelijking is gegoten is onhandig om uit de experimentele gegevens KM en Vmax te bepalen. Daarom heeft men deze vergelijking getransformeerd naar een lineaire vergelijking (door de reciproke te nemen) waarmee men de Lineweaver-Burk plot kan verkrijgen (die een rechte lijn geeft als men 1/v0 t.o.v. 1/s uitzet).
![]()
Helling = KM/Vmax Snijpunt y-as = 1/Vmax Snijpunt x-as = -1/KM
| Naam: sacharose Triviaalnamen: (kristal)suiker, sucrose, rietsuiker, bietsuiker Formule: C12H22O11 |
 |
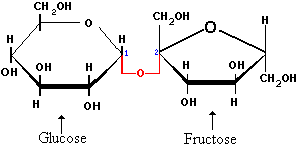 |
| Naam:
glucose Triviaalnamen: druivesuiker, dextrose, aldohexose Formule: C6H12O6 |
 |
|
| Naam:
fructose Triviaalnamen: vruchtensuiker, ketohexose Formule: C6H12O6 |
 |
|
| GIST:
De foto laat gistcellen onder de
microscoop zien. Eén gram gist bevat er ongeveer vijftien miljard van. |
|
|
Gisten zijn eencellige micro-organismen met een grootte van circa 0,005-0,020 mm. Anders dan bacteriën hebben gistcellen hun DNA in de celkern opgeborgen; dat hebben zij gemeen met planten, dieren en mensen, waardoor zij ingedeeld zijn bij de eukaryote organismen.
Al vele duizenden jaren spelen gisten een belangrijke rol in het leven van de mens. De oudst bekende vorm van gistgebruik is de spontane omzetting van granen in bier en van druiven in wijn. Daarnaast wordt gist al eeuwen ingezet voor het laten rijzen van brooddeeg; aanvankelijk werd hiervoor de gist gebruikt die overbleef na de biergisting, maar sinds het eind van de negentiende eeuw wordt bakkersgist in toenemende mate gekweekt. Gist wordt ook gegeten. Als vitaminesupplement zijn er gisttabletten en als broodbeleg is er gistpasta(marmiet) te koop. Gist in de vorm van gistextract wordt als hartige smaakstof toegevoegd aan veel voedingsmiddelen, vooral aan soepen en sauzen.
Dankzij het onderzoek van Louis Pasteur (1822-1895) werd duidelijk dat tijdens de wijngisting een toename optrad van het gewicht van de gist die gekoppeld was aan een toename van de hoeveelheid geproduceerde koolstofdioxide. Hieruit concludeerde hij dat er een chemische omzetting plaats vond. Verder onderzoek toonde aan dat gistcellen verantwoordelijk zijn voor de omzetting van suikers in alcohol en koolstofdioxide. Tevens bleken extracten van gistcellen ook andere chemische reacties te katalyseren. De hiervoor verantwoordelijke stoffen werden enzymen Genoemd, wat in het Grieks "in gist" betekent.
Alle tot nu toe bekende gistsoorten zijn in staat om tenminste één suiker, bijvoorbeeld glucose of fructose, te gebruiken als enige bron van koolstof en energie. In aanwezigheid van zuurstof, dus bij de dissimilatie van de gist worden de suikers geheel omgezet in water en koolstofdioxide. Er wordt zoveel energie geproduceerd dat de gistcellen zich snel kunnen vermeerderen. Bij de alcoholische vergisting worden de gistcellen bij afwezigheid van zuurstof gedwongen om de suikers maar gedeeltelijk af te breken om in hun energiebehoefte te voorzien, dit levert echter veel minder energie op, als bijproducten ontstaan alcohol en CO2. Ook bij het broodbakken treedt een alcoholvergisting op.
27-02-2005