999 Experimenteerdoos
Bellen
Blazen


|
999 Experimenteerdoos |
 |
 |
Datum: Juli 2006
Principe:
Experimenten met zeepbellen.
Materiaal:
| 999 heeft een experimenteerdoos uitgebracht waarmee men experimenten kan doen met zeepbellen. De doos bevat tevens een uitgebreide experimenteerhandleiding. |

|
|
|
|
Resultaten en uitvoering:
 |
 |
 
|

|
 |
 |
| Grote bellen tussen je handen maken. |

|

|

|

|
|
 |
|

|

|

|

|

|

|

|

|

|
Binnen in een kubus maar ook in ander geometrische vormen kun je prachtige zeepbelvormen creŰren. |
 Mooie bellen blazen met een trechter en vervolgens bellen blazen in die bellen. |

|

|

|
 Bellen in bellen blazen |

|

|
 3 bellen aan elkaar. Ze bibberen nogal, vandaar de ietwat vage foto. |
|
Met deze doos en zijn uitstekende handleiding zijn nog meer experimenten uit te voeren. Deze vond mij dochter echter de leukste. De zeepfilmen die zich vormen tussen de ribben van de kubus of andere driedimensionale structuren die men ook kan bouwen doen dit volgens de wetten van de fysica. De structuur die uiteindelijke gevormd wordt is degene die een minimale energie vertegenwoordigd door het kleinst mogelijke oppervlak te vormen. Het is echter ook zo dat hoe ingewikkelder de structuur is des te meer mogelijkheden er zijn om een minimaal oppervlak te verkrijgen voor dezelfde structuur. Er zijn dus verschillende stabiele toestanden van minimale energie voor een bepaalde structuur. Uit de literatuur hierbeneden kun je afleiden dat ook op wiskundig gebied (minimaal oppervlaktes) zeepbellen veel uitdagingen bevatten. Er is dan ook veel over geschreven. |
|
Opmerkingen:
|
Literatuur:
Relevante websites: |
Achtergrondinformatie:
| Zeepmoleculen | |
|
Detergentia
(waaronder ook de zepen vallen) bestaan uit lange moleculen waarvan we
gemakshalve zeggen dat ze een kop en een staar hebben. De kop is polair
en zit daarom graag in water (dat ook polair is) terwijl de staart
apolair is en daarom juist niet graag in water zit. Men spreekt ook wel
van hydrofiel (zit graag in het water) en hydrofoob (zit juist niet
graag in water).
Het kenmerk van deze stoffen is dus dat ze bij voorkeur op het
grensvlak van niet-mengbare stoffen gaan zitten (bv olie/water). De
staart hangt dan in de apolaire stof (de olie) terwijl de kop in het
polaire water hangt. Men noemt deze stoffen dan ook wel oppervlakte
actieve stoffen en in het engels "surfactants". |
|
| Detergentia verlagen de oppervlaktespanning door zich aan het oppervlak te concentreren. Deze verlaging is de basis voor de werking van wasmiddelen. De lange koolwaterstofketens van de zeepmoleculen of -ionen zijn slecht oplosbaar in water (ze zijn hydrofoob). Ze kunnen hun energie verlagen door door met de lucht naar het oppervalk te bewegen. Daar is schuimvorming een mogelijkheid om het grensvlak vloeistof-lucht te vergroten. De warmtebeweging van de moleculen heeft echter de neiging ze uniform door de oplossing te verspreiden. Er ontstaat dan een evenwicht waarbij de concentratie van zeepmoleculen aan het oppervlak groter is dan in de bulk. | 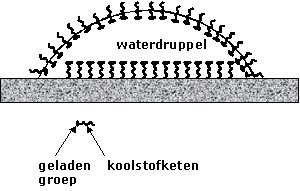 |
| In een zeepbel hebben we nu te maken met een bolvormige schil van vloeistof die gevuld is met lucht en omringd is met lucht. Alle zeepmoleculen die in de grenslaag vloeistof-gas zitten hebben een hogere energie en willen we nu het oppervlak verhogen (de bol groter maken) dan zullen we extra energie moeten toevoegen. | |
| Beschouwen we een zeepfilm die opgehangen is een draadraam zoals weergegeven is in de onderstaande figuur. Indien we het vlies groter willen maken door de beweegbare draad naar rechts te bewegen dan moeten we een beetje kracht uitoefenen. | |
|
Deze kracht is nodig om de microscopische
krachten tussen de moleculen op het lucht-gas interface
te overwinnen. Deze microscopische krachten
staan loodrecht op elke lijn in het oppervlak en de kracht die door deze
krachten per lengte-eenheid gegenereerd wordt noemt men de
oppervlaktespanning ss met als eenheid N/m. Dientengevolge noemt men de arbeid
die samenhangt met het vergroten van de film de oppervlakte spanning
arbeid. Ze wordt bepaald uit (in kJ):
|
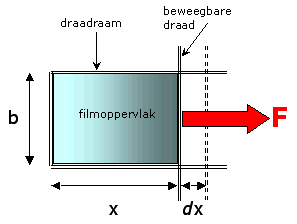 |
| waarin dA = 2.b.dx de verandering in het oppervlak van de film is. De factor 2 komt doordat er twee oppervlaktes in contact met lucht staan. De kracht die op de beweegbare draad wordt uitgeoefend als gevolg van de oppervlaktespanning effecten is F=2.b. ss waarin ss de oppervlaktespanning per lengte-eenheid is. | |
17-01-2017