

| Experimenten met zwavel |  |
 |
Datum: april 2003
Principe:
Proefjes met zwavel.
Materiaal:
|
|
Uitvoering:
|

|
Resultaat:
 |
 |
| verwarmen | uitgieten |
 |
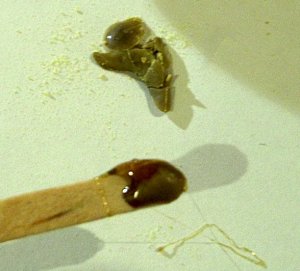 |
| blussen | gestold |
 |
 |
| QX3-microscoop | pH papiertjes |
Discussie en conclusie:
|
Waarnemingen:
Zwavel komt in twee modificaties voor (beiden S8). Beneden 95.5 °C rhombisch en boven deze temperatuur monoklien. Bij verhitting krijgen we de volgende verschijnselen:
Naast rhombische en monokliene zwavel is er nog een derde metastabiele vorm. Deze ontstaat wanneer men de visceuze zwavel te snel afkoelt (bv door onderdompeling in water). De macromoleculen blijven dan bestaan en er ontstaat plastische zwavel die bij lang staan weer overgaat in rhombische zwavel. De zwavelmoleculen kunnen met de zuurstof in de lucht reageren tot zwaveldioxide volgens: S + O2 --> SO2 In water vormt het zwaveldioxide waterstofsulfiet volgens: SO2 + 2H2O <=> HSO3- + H3O+ Er wordt dan zuur gevormd hetgeen dus de verklaring is waarom de pH papiertjes zuurvorming aangeven. |
Opmerkingen:
|
Literatuur:
Relevante websites: |
Achtergrondinformatie:
Thermodynamische data voor beide fases bij 298K is:
Zwavel komt zowel in zuivere vorm als in de vorm van mineralen voor. In mineralen treft men zwavel aan als sulfide of sulfaat, gebonden aan mineralen. Zwavel is een bestanddeel van insecticiden. Bij het vulkaniseren van rubber mengt men natuurrubber met zwavel en andere stoffen. Door verhitten vormt de zwavel verbindingen tussen de macromoleculen waaruit natuurrubber bestaat. De rubber behoudt zijn elastische eigenschappen, maar keert tevens tot zijn oorspronkelijke vorm terug. Vulkaniseert men met veel zwavel (30%), dan is het verkregen product hard en niet elastisch. Men noemt dit product eboniet. |
17-01-2017